Enem: lista de exercícios sobre NOX e oxirredução
Nesta lista de exercícios, você poderá testar o que aprendeu sobre NOX e oxirredução, temas importantíssimos para a prova de Química do Enem.
Publicado por: Murilo XovenQuestões
-
Questão 1
(Fuvest 2021) No fragmento a seguir, o autor explora conceitos químicos na forma de poesia:
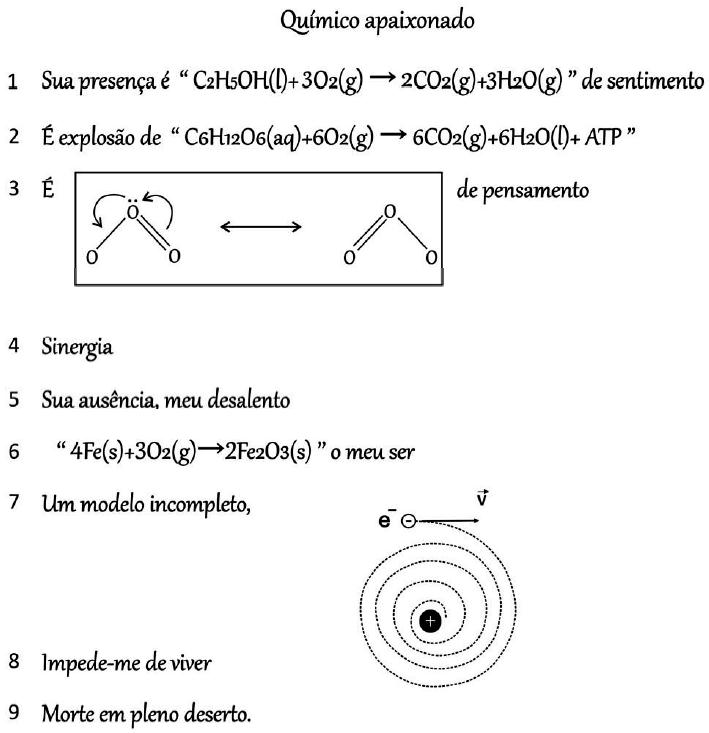
Wilmo Ernesto Francisco Junior, Ciência em prosa e verso –
Acepipes para quem ousa gostar (ou ensinar), 2018 (adaptado),
apud Lopes, MJ.M. Dissertação de Mestrado, 2019. Disponível em
http://www.repositorio.ufal.br/.Sobre os conceitos mencionados, foram feitas as seguintes afirmações:
I. A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de fotossíntese com consumo de gás carbônico.
II. A equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies é alterado, sendo associada à corrosão.
III. O modelo incompleto referido na linha 7 refere-se ao proposto por Thomson, que identificava a presença de partículas com carga negativa dentro de uma esfera.
Está correto o que se afirma no(s) item(ns):
a) I, apenas.
b) II, apenas.
c) I e III, apenas.
d) II e III, apenas.
e) I, II e III.
Letra b.
A equação química mostrada na linha 2 pode ser associada à liberação de energia, pois corresponde à reação de respiração celular e produz gás carbônico.
A equação química apresentada na linha 6 representa uma reação na qual o número de oxidação das espécies é alterado, sendo associada à corrosão. É a equação que representa o processo de produção da ferrugem (oxidação do ferro).
O modelo incompleto referido na linha 7 refere-se ao proposto por Bohr, que identificava a presença de partículas com carga negativa dentro de uma esfera.
-
Questão 2
(Unesp 2021) Analise as reações:
Reação 1 – Obtenção de água sanitária
Cl2 (g) + 2NaOH (aq) → NaClO (aq) + NaCl (aq) + H2O (l)
Reação 2 – Reação de carga de uma bateria chumbo/ácido
2PbSO4 (s) + 2H2O (l) → Pb (s) + PbO2 (s) + 2H2SO4 (aq)
Reação 3 – Combustão de magnésio metálico
Mg (s) + ½O2 (g) → MgO (s)
Reação 4 – Obtenção de cal
CaCO3 (s) → CaO (s) + CO2 (g)
São exemplos de oxirredução, que apresentam um reagente atuando simultaneamente como oxidante e redutor, as reações:
a) 1 e 3.
b) 2 e 3.
c) 1 e 4.
d) 2 e 4.
e) 1 e 2.
Letra e.
- Reação 1 – Obtenção de água sanitária:
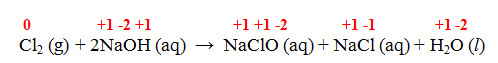
O Cl varia o NOX de 0 para +1 (agindo como redutor) e também de 0 para -1 (agindo como oxidante).
- Reação 2 – Reação de carga de uma bateria chumbo/ácido:
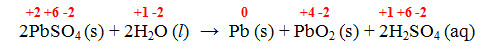
O Pb varia o NOX de +2 para 0 (agindo como oxidante) e também de +2 para +4 (agindo como redutor)
- Reação 3 – Combustão de magnésio metálico:
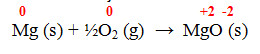
- Reação 4 – Obtenção de cal:
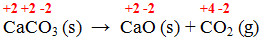
-
Questão 3
(Unesp 2021) As bacteriorrizas são exemplos de associações simbióticas entre bactérias e raízes de plantas leguminosas. Essas bactérias fixam o nitrogênio atmosférico (N2), transformando-o em amônia (NH3). Nessa transformação, o número de oxidação do elemento nitrogênio é alterado de:
a) +2 para –3, sendo reduzido.
b) +2 para +1, sendo reduzido.
c) 0 para +3, sendo oxidado.
d) 0 para +1, sendo oxidado.
e) 0 para –3, sendo reduzido.
-
Questão 4
(Farmep 2021) O iodo é um elemento relativamente raro, cuja forma elementar (I2) é produzida a partir de suas espécies iônicas encontradas na natureza. As algas marinhas e as águas-mães do processamento do salitre do Chile são fontes naturais de íons iodeto (I–) e iodato (IO3–), respectivamente. A conversão desses íons em iodo molecular ocorre de acordo com as equações 1 e 2.
Equação 1:
MnO2 + 2KI + 2H2SO4 → Mn2+ + I2 + 2K+ + 2H2O + 2SO42–
Equação 2:
2IO3– + 5NaHSO3 → I2 + 5Na+ + 3H+ + 5SO42– + H2O
De acordo com os processos descritos, o elemento iodo sofre:
a) redução na equação 1 e oxidação na equação 2.
b) oxidação em ambas as equações.
c) redução em ambas as equações.
d) oxirredução apenas na equação 1.
e) oxidação na equação 1 e redução na equação 2.
Letra e.
Equação 1:
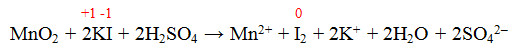
O NOX do I variou de -1 para 0 (aumentou), portanto o I sofreu uma oxidação.
Equação 2:
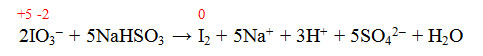
O NOX do I variou de +5 para 0 (diminuiu), portanto o I sofreu uma redução.
-
Questão 5
(UEPG 2019) Considerando a reação abaixo, assinale o que for correto.
6 CO2 + 6 H2O → C6H12O6 + 6 O2
01. A reação química descrita acima é uma reação de oxidorredução.
02. O carbono (C) é o elemento reduzido.
04. O hidrogênio (H) é o elemento oxidado.
08. O número de oxidação (NOX) do elemento carbono (C) diminui.
16. O oxigênio (O) é o elemento oxidado.
A única afirmação incorreta é a 04.
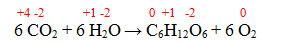
A reação química descrita acima é uma reação de oxirredução, pois o carbono está reduzindo (diminuiu seu NOX) e o oxigênio oxidando (aumentou seu NOX).
O carbono (C) é o elemento reduzido, pois seu NOX sofreu uma diminuição.
O hidrogênio (H) não sofre oxidação e nem redução, seu NOX não foi alterado.
O número de oxidação (NOX) do elemento carbono (C) diminui, pois ele sofreu uma redução.
O oxigênio (O) é o elemento oxidado, pois seu NOX sofreu aumento.
-
Questão 6
(Fatec 2019) A reação que ocorre entre a fosfina e o oxigênio é representada pela equação química:
2 PH3 (g) + 4 O2 (g) → P2O5 (g) + 3 H2O (g)
As substâncias que atuam como agente oxidante e agente redutor desse processo são, respectivamente:
a) O2 e PH3.
b) O2 e H2O.
c) O2 e P2O5.
d) PH3 e H2O.
e) PH3 e P2O5.
Letra a.
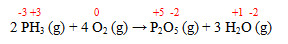
PH3 sofre oxidação, portanto é o redutor; e o O2 sofre redução, portanto é o oxidante.
-
Questão 7
(Unesp 2020)
Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio.
Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus.
Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
(www.inovacaotecnologica.com.br. Adaptado.)
No nitreto de gálio-alumínio, os números de oxidação do nitrogênio e do par Al-Ga são, respectivamente:
a) 0 e 0.
b) +6 e –6.
c) +1 e +1.
d) –3 e +3.
e) –2 e +2.
Letra d.
AlGaN é uma estrutura neutra, e a soma algébrica dos números de oxidação deve ser igual a zero.
O NOX do N, quando for o mais eletronegativo da estrutura (que é o caso), é -3. Portanto, o NOX do par Al-Ga é +3.
-
Questão 8
(FMABC 2019) A reação a seguir representa a dissolução do metal ouro com água-régia, uma mistura de ácido clorídrico e ácido nítrico concentrados, na proporção de 3:1, em volume.
Au(s) + NO3- (aq) + 4H+(aq) + 4Cl– →
→ AuCl4- (aq) + 2H2O(l) + NO(g)
O número de oxidação do redutor, nessa reação, varia de:
a) +5 para +2.
b) +1 para 0.
c) –1 para +1.
d) 0 para +3.
e) +1 para +3.
Letra d.
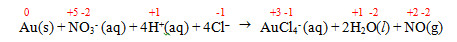
Redutor é a espécie química que sofre oxidação. O Au sofreu aumento do NOX, variando de 0 para +3.
-
Questão 9
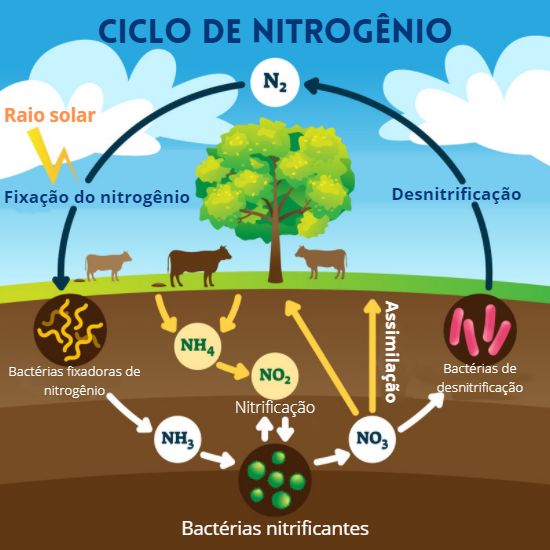
(Enem 2014) A aplicação excessiva de fertilizantes nitrogenados na agricultura pode acarretar alterações no solo e na água pelo acúmulo de compostos nitrogenados, principalmente a forma mais oxidada, favorecendo a proliferação de algas e plantas aquáticas e alterando o ciclo do nitrogênio, representado no esquema. A espécie nitrogenada mais oxidada tem sua quantidade controlada por ação de microrganismos que promovem a reação de redução dessa espécie, no processo denominado desnitrificação.
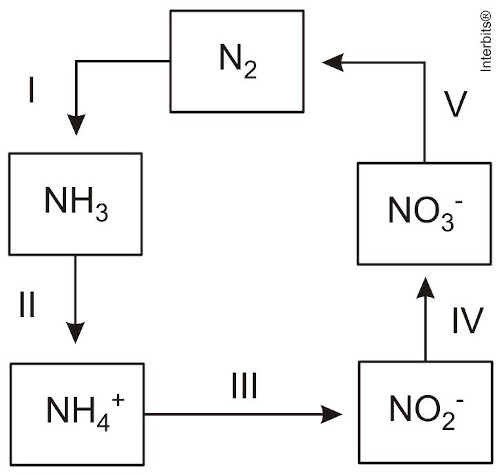
O processo citado está representado na etapa:
a) I.
b) II.
c) III.
d) IV.
e) V.
Letra e.
I – Diminuiu o NOX = reduziu.
0 -3 +1
N2 NH3II – Aumentou o NOX = oxidou.
-3 +1 +3 -2
NH3 NH4+III – Não houve alteração do NOX.
+3 -2 +3 -2
NH4+ NO2-IV – Aumentou o NOX = oxidou.
+3 -2 +5 -2
NO2- NO3-V – Diminuiu o NOX = reduziu.
+5 -2 0
NO3- N2A redução com maior variação de NOX ocorreu no processo V, variando cinco unidades, caracterizando o processo de desnitrificação realizado por bactérias anaeróbicas.
-
Questão 10
(Enem digital 2020) A rotação de culturas, juntamente com a cobertura permanente e o mínimo revolvimento do solo, compõem os princípios básicos do sistema de plantio direto. O aumento da diversidade biológica do solo contribui para a estabilidade da produção agrícola por causa de diversos fatores, entre eles o processo de fixação biológica de nitrogênio, realizado por bactérias.
FRANCHINI, J. C. et al. Importância da rotação de culturas para a produção agrícola sustentável no Paraná. Londrina: Embrapa Soja, 2011 (adaptado).
Nesse processo biológico, ocorre a transformação de:
a) N2 em NH3.
b) NO3− em N2.
c) NH3 em NH4 +.
d) NO2 em NO3-.
e) NH4+ em NO2−.
-
Questão 11
(Enem 2019) Estudos mostram o desenvolvimento de biochips utilizados para auxiliar o diagnóstico de diabetes melito, doença evidenciada pelo excesso de glicose no organismo. O teste é simples e consiste em duas reações sequenciais na superfície do biochip, entre a amostra de soro sanguíneo do paciente, enzimas específicas e reagente (iodeto de potássio, Kl), conforme mostrado na imagem.
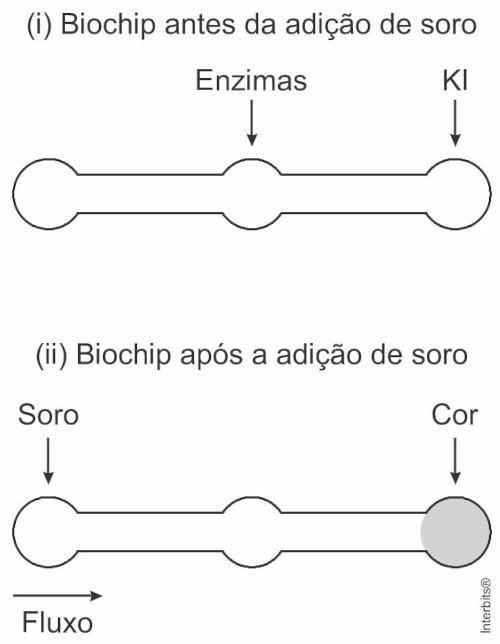
Após a adição de soro sanguíneo, o fluxo desloca-se espontaneamente da esquerda para a direita (ii), promovendo reações sequenciais, conforme as equações 1 e 2. Na primeira, há conversão de glicose do sangue em ácido glucônico, gerando peróxido de hidrogênio.
Equação 1

Equação 2
Na segunda, o peróxido de hidrogênio reage com íons iodeto gerando o íon tri-iodeto, água e oxigênio.
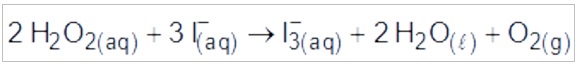
GARCIA, P. T. et al. A Handheld Stamping Process to Fabricate Microfluidic Paper-Based Analytical Devices with Chemically Modified Surface for Clinical Assays. RSC Advances, v.4, 13 ago. 2014 (adaptado).
O tipo de reação que ocorre na superfície do biochip, nas duas reações do processo, é:
a) análise.
b) síntese.
c) oxirredução.
d) complexação.
e) ácido-base.
Letra c.
Ocorrem reações de oxirredução, pois há variação do NOX do carbono e oxigênio, no primeiro processo, e do oxigênio e iodo, no segundo processo.
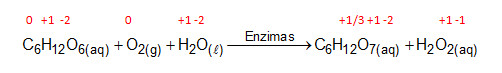
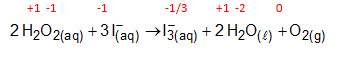
-
Questão 12
(Enem 2018) As células e os organismos precisam realizar trabalho para permanecerem vivos e se reproduzirem. A energia metabólica necessária para a realização desse trabalho é oriunda da oxidação de combustíveis, gerados no ciclo do carbono, por meio de processos capazes de interconverter diferentes formas da energia.
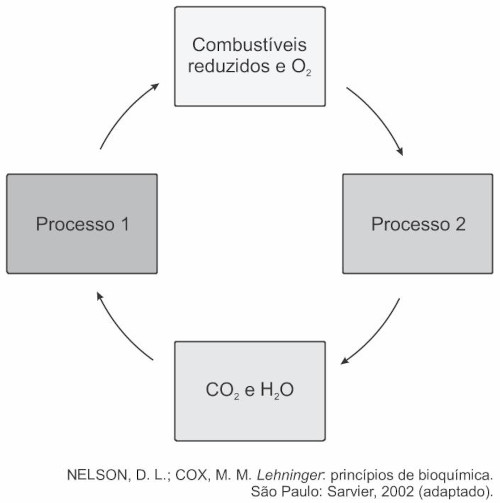
Nesse ciclo, a formação de combustíveis está vinculada à conversão de energia:
a) térmica em cinética.
b) química em térmica.
c) eletroquímica em calor.
d) cinética em eletromagnética.
e) eletromagnética em química.
Letra e.
O primeiro processo é a fotossíntese e depende da luz:

O segundo processo é a queima de combustíveis:
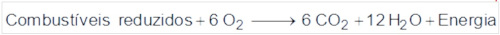
Portanto, trata-se de uma conversão de energia eletromagnética em energia química.
-
Questão 13
(Enem 2015) Alimentos em conserva são frequentemente armazenados em latas metálicas seladas, fabricadas com um material chamado folha de flandres, que consiste de uma chapa de aço revestida com uma fina camada de estanho, metal brilhante e de difícil oxidação. É comum que a superfície interna seja ainda revestida por uma camada de verniz à base de epóxi, embora também existam latas sem esse revestimento, apresentando uma camada de estanho mais espessa.
SANTANA. V. M. S. A leitura e a química das substâncias. Cadernos PDE. Ivaiporã Secretaria de Estado da Educação do Paraná (SEED); Universidade Estadual de Londrina, 2010 (adaptado).
Comprar uma lata de conserva amassada no supermercado é desaconselhável porque o amassado pode:
a) alterar a pressão no interior da lata, promovendo a degradação acelerada do alimento.
b) romper a camada de estanho, permitindo a corrosão do ferro e alterações do alimento.
c) prejudicar o apelo visual da embalagem, apesar de não afetar as propriedades do alimento.
d) romper a camada de verniz, fazendo com que o metal tóxico estanho contamine o alimento.
e) desprender camadas de verniz, que se dissolverão no meio aquoso, contaminando o alimento.
Letra B. O problema de uma lata amassada é o possível rompimento da camada protetora da embalagem, que é feita de estanho. Isso resulta no contato direto do alimento com o metal da embalagem, o que pode provocar uma reação de oxirredução e contaminar o alimento.
-
Questão 14
(Enem 2ª aplicação 2016) Utensílios de uso cotidiano e ferramentas que contêm ferro em sua liga metálica tendem a sofrer processo corrosivo e enferrujar. A corrosão é um processo eletroquímico e, no caso do ferro, ocorre a precipitação do óxido de ferro (III) hidratado, substância marrom pouco solúvel, conhecida como ferrugem. Esse processo corrosivo é, de maneira geral, representado pela equação química:
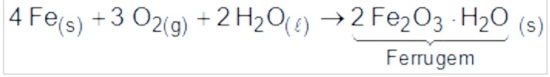
Uma forma de impedir o processo corrosivo nesses utensílios é
a) renovar sua superfície, polindo-a semanalmente.
b) evitar o contato do utensílio com o calor, isolando-o termicamente.
c) impermeabilizar a superfície, isolando-a de seu contato com o ar úmido.
d) esterilizar frequentemente os utensílios, impedindo a proliferação de bactérias.
e) guardar os utensílios em embalagens, isolando-os do contato com outros objetos.
-
Questão 15
(Enem 2ª aplicação 2014) A indústria têxtil é responsável por um consumo elevado de água e de outros produtos, gerando grande quantidade de efluentes com concentração alta e composição complexa, principalmente nos processos de tingimento e acabamento.
Visando minimizar os efeitos ambientais nocivos ocasionados pela grande quantidade de efluente contaminado, a catálise – quebra de moléculas – recebeu atenção especial, visto que:
a) permite a estocagem correta do efluente, evitando a contaminação de rios e lagos.
b) os catalisadores são substâncias que têm como objetivo principal a neutralização do pH do meio.
c) pode recuperar todos os produtos químicos presentes na água, permitindo a reutilização desses compostos.
d) associada a processos oxidativos, pode provocar a completa mineralização dos contaminantes, formando gás carbônico e água.
e) permite o retorno do efluente contaminado para o processo, uma vez que provoca a floculação dos produtos, facilitando a separação.
Letra d. Produtos insolúveis em água (mineralização dos contaminantes), gás carbônico e água são provocados e gerados por processos de catálise associados a processos oxidativos.
-
Questão 16
(Enem Digital 2020) O elemento ferro é essencial em nossa alimentação, pois ajuda a prevenir doenças como a anemia. Normalmente, na alimentação é ingerido na forma de Fe3+, sendo necessário o uso de agentes auxiliares de absorção, como o ácido ascórbico (vitamina C), cuja ação pode ser representada pelo esquema reacional a seguir.
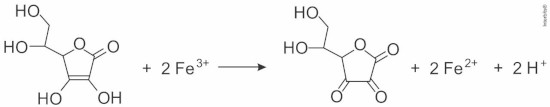
A ação do ácido ascórbico ocorre por meio de uma reação de:
a) eliminação.
b) substituição.
c) oxirredução.
d) neutralização.
e) hidrogenação.
Letra c. Por meio de uma simples observação no esquema demonstrado no enunciado, podemos constatar que o ferro sofreu redução, pois seu NOX diminuiu, e os carbonos que possuíam ligações duplas nos reagentes sofreram oxidação, portanto trata-se de uma reação de oxirredução.
-
Questão 17
(Enem Digital 2020) Os objetos de prata tendem a escurecer com o tempo, em contato com compostos de enxofre, por causa da formação de uma película superficial de sulfeto de prata (Ag2S), que é escuro. Um método muito simples para restaurar a superfície original desses objetos é mergulhá-los em uma solução diluída aquecida de hidróxido de sódio (NaOH), contida em uma panela comum de alumínio. A equação química que ilustra esse processo é:

A restauração do objeto de prata ocorre por causa do(a):
a) prata, que reduz o enxofre.
b) íon sulfeto, que sofre oxidação.
c) íon hidróxido, que atua como agente oxidante.
d) alumínio, que atua como agente redutor no processo.
e) variação do pH do meio reacional, que aumenta durante a reação.
Letra D.
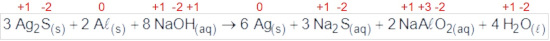
O alumínio sofre oxidação, pois seu NOX aumenta de 0 para +3 e, portanto, é o agente redutor do processo.
-
Questão 18
(Enem PPL 2016) Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:

O aquecimento dentro da bolsa ocorre por causa da:
a) redução sofrida pelo oxigênio, que é uma reação exotérmica.
b) oxidação sofrida pelo magnésio, que é uma reação exotérmica.
c) redução sofrida pelo magnésio, que é uma reação endotérmica.
d) oxidação sofrida pelo hidrogênio, que é uma reação exotérmica.
e) redução sofrida pelo hidrogênio, que é uma reação endotérmica.
Letra b.
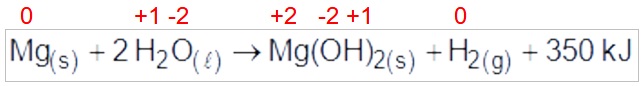
O magnésio sofre oxidação, pois seu NOX sofre um aumento e a reação é exotérmica, pois o calor está sendo liberado nos produtos.