Exercícios sobre cálculo do conteúdo calorífico ou calorias
Os exercícios sobre cálculo do conteúdo calorífico ou calorias são feitos tendo como ajuda a seguinte fórmula: Q = m . c . ∆t.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(UFPR) Chamamos de energéticos ou calóricos os alimentos que, quando metabolizados, liberam energia química aproveitável pelo organismo. Essa energia é quantificada através da unidade física denominada caloria, que é a quantidade de energia necessária para elevar, em um grau, um grama de água. A quantidade de energia liberada por um alimento pode ser quantificada quando se usa a energia liberada na sua combustão para aquecer uma massa conhecida de água contida em um recipiente isolado termicamente (calorímetro de água). Em um experimento para se determinar a quantidade de calorias presente em castanhas e nozes, obtiveram-se os resultados apresentados na
tabela abaixo:
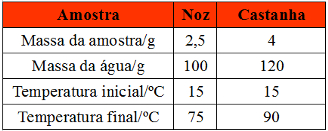
Tabela de exercício com quantidade de calorias presente em castanhas e nozesCom base no exposto acima e sabendo que o calor específico da água é igual a 1,0 cal g-1 ºC-1, é correto afirmar:
a) Esses resultados indicam que se uma pessoa ingerir 1,0 grama de nozes terá disponível 2400 calorias, enquanto, se ingerir a mesma quantidade de castanha, terá disponível 2250 calorias.
b) A castanha é duas vezes mais calórica do que a noz.
c) A quantidade de energia liberada na queima da noz é de 9000 calorias, e na queima da castanha é de 6000 calorias.
d) Um indivíduo que gasta cerca de 240 calorias em uma caminhada deve ingerir 10 g de castanha ou 225 gramas de nozes para repor as calorias consumidas.
e) A razão entre a quantidade de calorias liberadas na queima da castanha em relação à queima da noz corresponde a 2,5.
Alternativa “a”.
a) Correta:
Noz: Q = m . c . ∆t Castanha: Q = m . c . ∆t
Q = 100 . 1 . (75-15) Q = 120 . 1 . (90-15)
Q = 6000 cal/2,5 g de Noz Q = 9000 cal/4,0 g de Castanha
Q = 2400 cal/g de Noz Q = 2250 cal/g de Castanha
b) Incorreta:
Qcastanha = 2250 cal = 0,9375
Qnoz 2400 calc) Incorreta. Conforme calculado no item “a”, a queima da noz liberou 6000 calorias, e queima da castanha, 9000 calorias.
d) Incorreta.
Q = 240 cal
noz: 2400 cal ------ 1 g castanha: 2250 cal ------ 1 g
240 cal ------- mn 240 cal ------- mc
mn = 0,10g mc ≈ 0,11ge) Incorreta. Conforme já explicado no item “b”, a razão entre a quantidade de calorias liberadas na queima da castanha em relação à queima da noz corresponde a 0,9375, e não a 2,5.
-
Questão 2
(Fuvest-SP) Energia térmica, obtida a partir da conversão de energia solar, pode ser armazenada em grandes recipientes isolados, contendo sais fundidos em altas temperaturas. Para isso, pode-se utilizar o sal nitrato de sódio (NaNO3), aumentando sua temperatura de 300 ºC para 550 ºC, fazendo-se assim uma reserva para períodos sem insolação. Essa energia armazenada poderá ser recuperada, com a temperatura do sal retornando a 300 ºC. Para armazenar a mesma quantidade de energia que seria obtida com a queima de 1 L de gasolina, necessita-se de uma massa de NaNO3 igual a:
Dados: Poder calorífico da gasolina = 3,6 . 107 J/L
Calor específico do NaNO3 = 1,2 . 103 J/kg°C
a) 4,32 kg.b) 120 kg.
c) 240 kg.
d) 3 . 104 kg.
e) 3,6 . 104 kg.
Alternativa “b”.
A energia liberada na queima de 1 L de gasolina é de 3,6 . 107 J.
A energia armazenada pelo aumento da temperatura de uma massa m de NaNO3 é:
Q = m . c . ∆t
Como a variação da temperatura é 250ºC e o calor específico do sal é 1,2 . 103 J/kg°C , temos:
Q = m . (1,2 . 103 J/kg°C) . 250ºC
Para que a energia armazenada seja igual à liberada pela queima de 1 L de gasolina:
3,6 . 107 J = m . (1,2 . 103 J/kg°C) . 250ºC
m = 120 kg.
-
Questão 3
Uma reação química fez a temperatura de 10 g de água contidos em um calorímetro variar de 30ºC para 100ºC. Sabendo que o calor específico da água é igual a 1,0 cal g-1 ºC-1, quantas calorias foram fornecidas por essa reação?
a) 300 cal.
b) 1000 cal.
c) 1300 cal.
d) 30000 cal.
e) 700 cal.
Alternativa “e”.
Q = m . c . ∆t
Q = 10g . 1 cal/g.ºC . (100 - 30)ºC
Q = 10g . 1 cal/g.ºC . 70ºC
Q = 700 cal
-
Questão 4
Qual a variação da temperatura sofrida por 200 g de água que receberam 2 kJ de calor?
a)0,01 ºC
b) 400 ºC
c) 2,39 ºC
d) 95,7 ºC
e) 4,78 ºC
Alternativa “c”.
Primeiro precisamos converter o calor que está em kJ para calorias:
1 kJ = 103J
2 kJ = 203J
4,18 J ------- 1 cal
203J ---------xx ≈ 478,47 cal
Agora aplicamos esse valor na fórmula:
Q = m . c . ∆t
∆t = __Q__
m . c∆t = __478,47 cal____
200 g . 1 cal/gºC∆t ≈ 2,39 ºC