Exercícios sobre o cálculo da entalpia de uma reação
Esta lista de exercícios testará suas habilidades para realizar o cálculo da variação da entalpia de uma reação.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
(IF-GO) O trifluormetano, CHF3, é produzido pela fluoração do gás metano, de acordo com a equação abaixo não balanceada.
1CH4(g) + 1F2(g) → 1CHF3(g) + 1HF(g)
Dados:
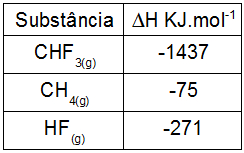
A entalpia-padrão da reação de fluoração do gás metano, em kJ.mol–1, é igual a:
a) + 1.633
b) + 2.175
c) – 1.633
d) – 2.175
e) – 2.325
Letra d). Confira o passo a passo para a determinação da variação de entalpia:
1o Passo: balancear a equação colocando o coeficiente 3 nos participantes F2 e HF.
1CH4(g) + 3F2(g) → 1CHF3(g) + 3CHF3(g)
2o Passo: calcular a entalpia dos produtos (Hp) multiplicando o coeficiente de cada participante pela sua entalpia e, depois, somando os resultados:
Hp = 1.HCHF3 + 3. HHF
Hp = 1.(-1437) + 3.(-271)
Hp = -1437 - 813
Hp = - 2250 KJ.mol-1
3o Passo: calcular a entalpia dos reagentes (Hr) multiplicando o coeficiente de cada participante pela sua entalpia e, depois, somando os resultados:
OBS.: Como o F2(g) é uma substância simples, sua entalpia de formação é igual a 0.
Hr = 1.HCH4 + 1. HF2
Hr = 1.(-75) + 1.(0)
Hr = -75 KJ.mol-1
4o Passo: calcular a variação da entalpia.
∆H = Hp – Hr
∆H= - 2250 - (-75)
∆H= - 2250 + 75
∆H= -2175 KJ.mol-1
-
Questão 2
(UEA-AM) Octano, C8H18, um dos componentes da gasolina, pode ser obtido sinteticamente a partir dos gases butano, C4H10, e but-1-eno, C4H8, por meio de um processo catalítico conhecido como alquilação. Essa síntese pode ser representada pela equação:
C4H10(g) + C4H8(g) → C8H18(l)
Sabendo que as entalpias-padrão de formação do butano, do but-1-eno e do octano são, respectiva e aproximadamente, em kJ/mol, iguais a –2 880, zero e –5 470, é correto afirmar que a síntese de 1 mol de octano por essa reação:
a) absorve 2 590 kJ.
b) absorve 5 470 kJ.
c) libera 2 590 kJ.
d) libera 5 470 kJ.
e) libera 8 350 kJ.
Letra c).
1o Passo: cálculo da entalpia dos produtos (Hp).
Hp = 1.H C8H18
Hp = 1.(-5470)
Hp = -5470 KJ.mol-1
2o Passo: cálculo da entalpia dos reagentes (Hr).
OBS.: Como o Cl2(g) é uma substância simples, sua entalpia de formação é igual a 0.
Hr = 1.HC4H10 + 3. HC4H8
Hr = 1.(-2 880) + 1.(0)
Hr = -2 880 KJ.mol-1
3o Passo: cálculo da variação da entalpia.
∆H = Hp – Hr
∆H= -5470 - (-2 880)
∆H= -5470 + 2 880
∆H= -2590 KJ.mol-1
Como o resultado é negativo, a energia está sendo liberada.
-
Questão 3
O gás monóxido de carbono já foi utilizado, há muito tempo, como combustível para veículos. Inicialmente ele era obtido a partir da combustão parcial da madeira. Posteriormente, quando adicionado aos veículos, reagia com o gás oxigênio, formando o dióxido de carbono. Essa reação de combustão liberava cerca de 57 Kcal/mol. Se a entalpia de formação do dióxido de carbono é igual a -94 Kcal/mol, qual é o valor da entalpia do monóxido de carbono?
CO(g) + ½ O2(g) → CO2(g)
a) – 73,0 kcal/mol.
b) – 511,0 kcal/mol.
c) + 7,3,0 kcal/mol.
d) + 15,10 kcal/mol.
e) – 37 kcal/mol.
Letra e).
1o Passo: variação da entalpia - ∆H= -57 KJ/mol (negativo porque o enunciado informa que a energia foi liberada).
2o Passo: cálculo da entalpia dos produtos (Hp).
Hp = 1.HCO2(g)
Hp = 1.(-94)
Hp = - 94 KJ.mol-1
3o Passo: cálculo da entalpia dos reagentes (Hr).
OBS.: Como o O2(g) é uma substância simples, sua entalpia de formação é igual a 0.
Hr = 1.HCO + ½ . HO2(g)
Hr = HCO + ½ .(0)
Hr = HCO KJ.mol-1
4o Passo: cálculo da variação da entalpia.
∆H = Hp – Hr
-57= - 94 - (HCO)
HCO= -94 + 57
HCO = -37 KJ.mol-1
-
Questão 4
O ferro fundido é obtido pela indústria siderúrgica a partir da reação entre a hematita e o gás monóxido de carbono, como representado na equação a seguir:
Fe2O3 + 3CO → 2 Fe + 3CO2
A partir dos valores das entalpias de formação de cada um dos componentes da reação, qual é o valor da variação de entalpia?
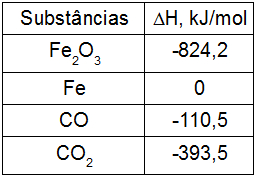
a) 24,8 kJ/mol
b) –24,8 kJ/mol
c) 541,2 kJ/mol
d) –541,2 kJ/mol
e) 1328,2 kJ/mol
Letra b).
1o Passo: cálculo da entalpia dos produtos (Hp).
OBS.: Como o Fe(s) é uma substância simples, sua entalpia de formação é igual a 0.
Hp = 2.HFe + 3.HCO2
Hp = 2.0 + 3.(-393,5)
Hp = 0 + (-1180,5) KJ.mol-1
Hp = -1180,5 KJ.mol-1
2o Passo: cálculo da entalpia dos reagentes (Hr).
Hr = 1.HFe2O3 + 3. HCO
Hr = 1.(-824,2) + 3.(-110,5)
Hr = -824,2 – 331,5
Hr = - 1155,7 KJ.mol-1
3o Passo: cálculo da variação da entalpia.
∆H = Hp – Hr
∆H= -1180,5 - (- 1155,7)
∆H= -1180,5 + 1155,7
∆H= -24,8 KJ.mol-1
Como o resultado é negativo, a energia está sendo liberada.