Exercícios sobre Diferença de Potencial de uma Pilha
Existe um potencial de redução e um de oxidação nos eletrodos de cada pilha, sendo que essa diferença de potencial pode ser medida por um voltímetro.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Baseado na lista de potenciais padrões de redução abaixo, responda qual espécie química entre os íons indicados nas alternativas é o melhor agente oxidante:
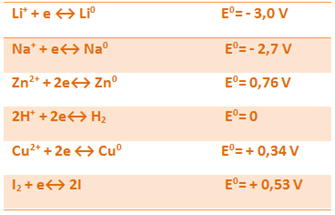
a) Li0
b) Na+
c) Zn2+
d) Cu2+
e) I2
Alternativa “e”.
Numa pilha, o agente oxidante é o que possui maior tendência de se reduzir, isto é, o que possui maior valor de potencial padrão de redução, que nesse caso é o I2 (E0= + 0,53).
-
Questão 2
Considere as seguintes semirreações para uma determinada pilha:
Ag+ + e- ↔ Ag0 E0= +0,80 V
Mg2+ + 2e- ↔ Mg0 E0= -2,37 V
a. Qual é a semirreação de cada eletrodo?
b.Identifique o cátodo, o ânodo, o polo negativo e o polo positivo.
c.Qual é o valor de ∆E0?
d.Qual é o melhor agente oxidante da pilha?
a. Redução: Ag+ + e- ↔ Ag0
Oxidação: Mg2+ ↔ Mg0+ 2e-
b. Cátodo (polo positivo): prata; ânodo (polo negativo): magnésio.
c. ∆E0 = E0(cátodo) - E0(ânodo)
∆E0 = + 0,80 – (-2,37)
∆E0 = + 0,80 +2,37
∆E0 = + 3,17Vd. O íon Ag+, pois seu potencial de redução (E0) é maior que o do Mg2+.
-
Questão 3
(Unifesp) A bateria primária de lítio-iodo surgiu em 1967, nos Estados Unidos, revolucionando a história do marca-passo cardíaco. Ela pesa menos que 20g e apresenta longa duração, cerca de cinco a oito anos, evitando que o paciente tenha que se submeter a frequentes cirurgias para trocar o marca-passo. O esquema dessa bateria é representado na figura.
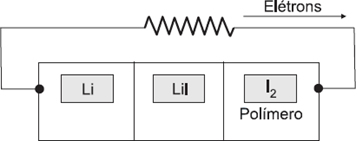
Para esta pilha, são dadas as semirreações de redução:
Li+ + e– → Li E0= – 3,05 V
I2 + 2e– → 2I– E0 = + 0,54 V
São feitas as seguintes afirmações sobre esta pilha:
I. No ânodo ocorre a redução do íon Li+.
II. A ddp da pilha é + 2,51 V.
III. O cátodo é o polímero/iodo.
IV. O agente oxidante é o I2.
São corretas as afirmações contidas apenas em:
a) I, II e III.
b) I, II e IV.
c) I e III.
d) II e III.
e) III e IV.
Alternativa “e”.
I. Incorreta, porque no ânodo ocorre a oxidação do Lítio:
Li → Li+ + e– (oxidação)
II. Incorreta.
E0 = E0maior – E0menor
E0 = + 0,54V – (– 3,05V)
E0 = + 3,59V
III. Correta.
O cátodo é constituído pelo polímero/iodo, porque ele possui maior potencial de redução.
IV. Correta.
I2 + 2e– →2I–
Agente oxidante
-
Questão 4
(PUC-SP) As pilhas de níquel-cádmio (“ni-cd”) são leves e recarregáveis, sendo utilizadas em muitos aparelhos portáteis, como telefones e câmaras de vídeo. Essas pilhas têm como característica o fato de os produtos formados durante a descarga serem insolúveis e ficarem aderidos nos eletrodos, permitindo a recarga quando ligada a uma fonte externa de energia elétrica.
Com base no texto e nas semirreações de redução fornecidas a seguir, a equação que melhor representa o processo de descarga de uma pilha de níquel-cádmio é:
Cd2+(aq) + 2 e- ↔ Cd(s) E0= – 0,40 V
Cd(OH)2(s) + 2 e- ↔ Cd(s) + 2OH-(aq) E0= – 0,81 V
Ni2+(aq) + 2 e- ↔ Ni(s) E0= – 0,23 VNi(OH)(s) + 1 e- ↔ Ni(OH)2(s) + OH-(aq) E0= + 0,49 V
a) Cd(s) + 2 Ni(OH)3(s) → Cd(OH)2(s) + 2 Ni(OH)2(s)
b) Cd(s) + Ni(s) → Cd2+(aq) + Ni2+(aq)
c) Cd(OH)2(s) + 2 Ni(OH)2(s) → Cd(s) + Ni(s)
d) Cd2+(aq) + Ni2+(aq) → Cd(s) + Ni(s)
e) Cd(s) + Ni(s) + 2OH-(aq) → Cd(OH)2(s) +Ni2+(aq)
Alternativa “a”.
Processo de descarga de uma bateria de níquel-cádmio:
Semirreação do ânodo: Cd(s) + 2OH-(aq) ↔ Cd(OH)2(s) + 2 e-
Semirreação do cátodo: 2 Ni(OH)3(s) + 2 e- ↔ 2 Ni(OH)2(s) + 2OH-(aq)
Reação Global: Cd(s) + 2 Ni(OH)3(s) → Cd(OH)2(s) + 2 Ni(OH)2(s)