Exercícios sobre Difusão e Efusão dos Gases
A difusão é o movimento espontâneo das partículas de um gás de se espalharem por outro gás, e a efusão é esse movimento por meio de pequenos orifícios.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
À mesma temperatura, um gás é quatro vezes mais denso que outro. Qual é a relação entre suas velocidades de efusão?
-
O gás mais denso difunde-se com metade da velocidade do gás menos denso.
-
O gás menos denso difunde-se com metade da velocidade do gás mais denso.
-
O gás mais denso difunde-se com o dobro da velocidade do gás menos denso.
-
O gás mais denso difunde-se com 1/4 da velocidade do gás menos denso.
-
O gás mais denso difunde-se com o quádruplo da velocidade do gás menos denso.
Alternativa “a”.
Considere que o gás menos denso é o Gás 1 e que o mais denso é o Gás 2. Pela Lei de Graham sobre a difusão e efusão dos gases, temos:
v1/ v2 = √(d2/ d1)
v1/ v2 = √(4/1)
v1/ v2 = 2
v2 = v1/2A velocidade do gás mais denso (2) é a metade do valor da velocidade do gás menos denso (1).
Lembre-se também que isso está correto também porque quanto mais densa for a substância gasosa, menor será a sua velocidade de efusão.
-
-
Questão 2
Qual alternativa indica corretamente a ordem crescente de velocidade de efusão dos gases relacionados? (Massas atômicas: He = 4, C = 12, H = 1, O = 16, N = 14 , S = 32).
-
He < CH4 < O2 < H2S < NH3
-
He < O2 < CH4 < NH3 < H2S
-
NH3< H2S < O2 < CH4 < He
-
He < CH4 < NH3 < O2 < H2S
-
H2S < O2 < NH3 < CH4 < He
Alternativa “d”.
Massas moleculares de cada um dos gases:
He = 4,0 g/mol;
CH4 = (12 + 4 . 1) =16,0 g/mol;
O2 = (2 . 16) = 32,0 g/mol;
H2S = (2 . 1 + 32) = 34,0 g/mol;
NH3= (14 + 3 . 1) = 17,0 g/mol.Quanto menor for a massa molar de um gás, mais rapidamente ele tenderá a se dispersar pelo ambiente e vice-versa. Assim, a ordem que a pessoa na sala sentirá os cheiros é igual à ordem crescente da massa molar das substâncias.
-
-
Questão 3
O hidrogênio atravessa um pequeno orifício com velocidade igual a 5,0 L/min, em uma determinada pressão (P) e temperatura (T). Qual a velocidade em que o oxigênio atravessa o mesmo orifício, na mesma P e T, em L/h? (Massas atômicas: H = 1 e O = 16).
-
0,02
-
1,25.
-
3,2.
-
75.
-
192.
Alternativa “d”.
Pela Lei de Graham sobre a difusão e efusão dos gases, temos:
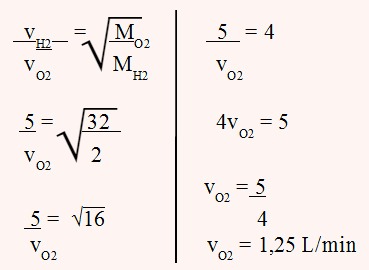
1,25 L ----- 1 min
x------------- 60 min (1h)
x = 75 L/h -
-
Questão 4
(UFRGS-RS) Um balão de borracha, desses usados em aniversários, cheio de ar, murcha após algum tempo. O fenômeno pode-se explicar pela:
-
Lei de Avogadro, que se refere à reatividade interna dos componentes.
-
Efusão do gás contido no balão para o meio externo.
-
Lei de Graham, que diz ser a velocidade de difusão diretamente proporcional à massa molar do gás.
-
Alta densidade do gás usado para encher o balão.
-
Pressão interna do gás que enruga o balão.
Alternativa “b”.
Um balão com o tempo murcha porque o gás dentro dele acaba passando pelos pequenos orifícios da borracha, caracterizando o fenômeno da efusão.
-
-
Questão 5
(UFBA) Numa sala fechada, foram abertos ao mesmo tempo três frascos com, respectivamente, gás amônia (17 g/mol), de odor característico forte e irritante, dióxido de enxofre (64 g/mol), de odor sufocante, e sulfeto de hidrogênio (34 g/mol), com cheiro de ovo podre. Uma pessoa na sala, a igual distância dos três frascos, sente os cheiros na seguinte ordem:
a) sulfeto de hidrogênio, amônia e dióxido de enxofre.
b) amônia, sulfeto de hidrogênio e dióxido de enxofre.
c) sulfeto de hidrogênio, dióxido de enxofre e amônia.
d) dióxido de enxofre, amônia e sulfeto de hidrogênio.
e) amônia, dióxido de enxofre e sulfeto de hidrogênio.Alternativa “b”.
Quanto menor for a massa molar de um gás, mais rapidamente ele tenderá a se dispersar pelo ambiente e vice-versa. Assim, a ordem que a pessoa na sala sentirá os cheiros é igual à ordem crescente da massa molar das substâncias:
Amônia, sulfeto de hidrogênio e dióxido de enxofre
17 g/mol < 34 g/mol < 64 g/mol -
Questão 6
O ar atmosférico que respiramos, quando puro e seco, pode ser considerado uma mistura ideal de gases, cuja constituição em volume é: N2 (78,0%), O2 (21,0%) e Ar (1,0%). A respeito dessa mistura gasosa, é correto afirmar que:
-
50,0 L dessa mistura serão constituídos por 38,0 L de N2(g), 10,5 L de O2(g) e 10,5 L de Ar.
-
Ela pode sofrer efusão gasosa, porém não pode sofrer difusão.
-
A fração de volume de cada gás é igual à respectiva fração de quantidade de matéria, em temperatura e pressão constantes.
-
Um balão de borracha (bexiga) cheio de gás hélio, deixado em contato com o ar atmosférico, murcha após algum tempo, pois a velocidade de efusão do gás hélio é menor que a do ar.
-
A massa molar média do ar atmosférico é maior que 32,0 g . mol–1.
Alternativa “c”.
Sendo a pressão e a temperatura constantes, verifica-se que a fração de volume de cada gás é igual à respectiva fração de quantidade de matéria. A velocidade de efusão do gás hélio é maior que a do ar em razão da menor massa molar do hélio (2 g/mol) em relação ao ar (29 g/mol). Isso explica porque uma bexiga com gás hélio murcha ao entrar em contato com o ar atmosférico.
As demais estão incorretas, conforme mostrado abaixo:
-
Incorreta. Pois 1% de 50 L deve ser o volume de argônio, que, no caso, seria 0,5 litros.
-
Incorreta. Toda e qualquer mistura de gases sofre efusão e difusão.
-
Correta.
-
Incorreta. Quanto menor a massa molecular, maior é a velocidade de efusão.
-
Incorreta. A massa molecular média é a média ponderada das massas molares dos gases constituintes da atmosfera. Nesse caso, temos que a massa molar média do ar seria: (78% . 28 + 21%.32 + 1%.40) /100 = 28,96 g/mol
-