Exercícios sobre Entalpia de Formação
A entalpia de formação é o calor liberado ou absorvido na formação de 1 mol de uma substância simples, no estado padrão, com H = 0.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Identifique a reação que define a variação da entalpia-padrão de formação:
a) 2 C(grafite) + 2 O2(g) → 2 CO2(g)
b) C(diamante) + O2(g) → CO2(g)
c) C(grafite) + O2(g) → CO2(g)
d) CaO(s) + 3 CO2(g) → CaCO3(g)
e) N2(g) + 3 H2(g) → 2 NH3(g)
Alternativa “c”.
Para ser a variação da entalpia-padrão de formação, é preciso que os reagentes sejam substâncias simples, no estado padrão e na sua forma alotrópica mais estável (o C(grafite) é a forma alotrópica do carbono mais comum), além de haver a formação de 1 mol de substância.
-
Questão 2
Do conjunto de substâncias abaixo, quais devem ter entalpia-padrão de formação (∆H0f) igual a zero:
a) água líquida.
b) nitrogênio gasoso.
c) oxigênio gasoso.
d) grafita.
e) diamante.
Alternativas “b”, “c” e “d”, porque essas são as substâncias que, a 1 atm de pressão e 25 ºC, encontram-se na sua forma alotrópica mais estável.
-
Questão 3
(PUC-MG) Sendo o ΔH de formação do óxido de cobre II igual a –37,6 kcal/mol e o ΔH de
formação do óxido de cobre I igual a –40,4 kcal/mol, o ΔH da reação:
Cu2O(s) + 1/2 O2(g) → 2 CuO(s)
será:
a) –34,8 kcal.
b) –115,6 kcal
c) –5,6 kcal.
d) +115,6 kcal.
e) +34,8 kcal.
Alternativa “a”.
O óxido de cobre II é CuO= -37,6 kcal/mol
O óxido de cobre I é Cu2O= -40,4 Kcal/mol1 Cu2O(s) + 1/2 O2(g)* → 2 CuO (s)
1mol . (-40,4) + 0 ------------------- 2 mol . (-37,6)
HR=(-40,4) -------------------------------HP=( -75,2)
* Observação: No 1/2 O2(g), o valor da entalpia é zero porque a toda substância simples no estado padrão atribui-se valor zero.
Sabendo que a variação da entalpia é ∆H = HP - HR
∆H=( -75,2)-(-40,4)
∆H=( -75,2)+40,4
∆H=-34,8 kcal -
Questão 4
(UNI-RIO) Os romanos utilizavam CaO como argamassa nas construções rochosas. O CaO era misturado com água, produzindo Ca(OH)2, que reagia lentamente com o CO2‚ atmosférico, dando calcário:
Ca(OH)2(s) + CO2(g) → CaCO3(s) + H2O(g)
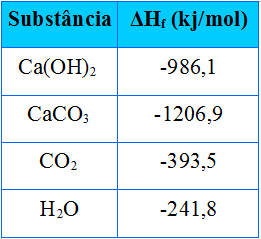
A partir dos dados da tabela anterior, a variação de entalpia da reação, em kJ/mol, será igual a:
a)138,2
b) - 69,1
c)-2828,3
d)+ 69,1
e)-220,8Alternativa “b”.
Ca(OH)2(s) + CO2(g) → CaCO3(s) + H2O(g)
∆H = HP - HR
∆H = ( HCaCO + HH2O ) - (HCa(OH)2+ HCO2)
∆H = ( - 1206,9 – 241,8 ) - (-986,1 – 393,5)
∆H = -1448,7 -(-1379,6)
ΔH= -1448,7+1379,6
ΔH= -69,1 kJ/mol