Exercícios sobre Equação Geral dos Gases
Através das três transformações gasosas (isotérmica, isobárica e isocórica), chega-se à equação geral dos gases (P.V/T=k).
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Mediu-se a temperatura de 20 L de gás hidrogênio (H2) e o valor encontrado foi de 27 ºC a 700 mmHg. O novo volume desse gás, a 87 ºC e 600 mmHg de pressão, será de:
-
75 L.
-
75,2 L.
-
28 L.
-
40 L.
-
38 L.
Alternativa “c”.
É importante lembrar que a temperatura deve ser dada obrigatoriamente em kelvin:
T (K) = T (ºC) + 273 T (K) = T (ºC) + 273
T (K) = 27 + 273 T (K) = 87 + 273
T (K) = 300 K T (K) = 360 KP1V1 = P2V2
T1 T2700 . 20 = 600 . V2
300 360
14 000 = 600 . V2
300 360
300 (600 . V2) = 14 000 . 360
180 000 . V2 = 5 040 000
V2 = 5 040 000
180 000
V2 = 28 L -
-
Questão 2
Uma massa fixa de um gás perfeito passa pelo ciclo ABCD, como desenhado, dentro de um pistão (cilindro com êmbolo). A temperatura em A é TA = 500 K.
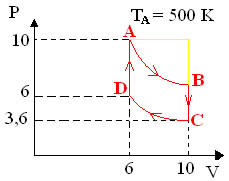
Identifique o nome das transformações gasosas, respectivamente:
A → B; B → C; C → D; D → A.
-
Isotérmica, isocórica, isotérmica, isocórica.
-
Isotérmica, isobárica, isotérmica, isobárica.
-
Isocórica, isotérmica, isocórica, isotérmica.
-
Isobárica, isotérmica, isotérmica, isocórica.
-
Isotérmica, isotérmica, isotérmica, isobárica.
Alternativa “a”.
Dados:
A B C D
PA = 10 PB = 6 PC = 3,6 PD = 6
VA = 6 VB = 10 VC = 10 VD = 6
TA = 500K TB = ? TC = ? TD = ?Precisamos usar a equação dos gases ideais para descobrir os valores das demais temperaturas e confirmar o tipo de transformação:
PAVA = PBVB
TA TB
10 . 6 = 6 . 10
500 TB
60 . TB = 30 000
TB = 500 K → A temperatura de A para B permaneceu a mesma, então é uma transformação isotérmica. Olhando no gráfico, nós confirmamos isso, porque de A → B, temos uma hipérbole (isoterma).PBVB = PCVC
TB TC
6 . 10 = 3,6 . 10
500 TC
60 . TC = 18 000
TC = 300 K → A temperatura de B para C diminuiu, mas vemos que o volume permaneceu igual (10 L), então é uma transformação isocórica.PCVC = PDVD
TC TD
3,6 . 10 = 6 . 6
300 TD
36. TD = 300
TD = 300 K → A temperatura de C para D permaneceu constante, sendo uma transformação isotérmica.De D → A, o volume permaneceu igual a 6L, sendo, portanto, uma transformação isocórica.
-
-
Questão 3
(Estácio-RJ) Um volume de 10 L de um gás perfeito teve sua pressão aumentada de 1 para 2 atm e sua temperatura aumentada de -73 °C para +127 °C. O volume final, em litros, alcançado pelo gás foi de:
a) 50
b) 40
c) 30
d) 10
e) 20Alternativa “d”.
T (K) = T (ºC) + 273 T (K) = T (ºC) + 273
T (K) = -73 + 273 T (K) = 127 + 273
T (K) = 200 K T (K) = 400 KP1V1 = P2V2
T1 T21 . 10 = 2. V2
200 400
400V2 = 4 000
V2 = 10 L -
Questão 4
(UCDB-MS) Certa massa de gás estava contida em um recipiente de 20 L, à temperatura de 27ºC e pressão de 4 atm. Sabendo que essa massa foi transferida para um reservatório de 60 L, à pressão de 4 atm, podemos afirmar que no novo reservatório:
-
A temperatura absoluta ficou reduzida a 1/3 da inicial.
-
A temperatura absoluta ficou reduzida de 1/3 da inicial.
-
A temperatura em ºC triplicou o seu valor inicial.
-
A temperatura em ºC ficou reduzida a 1/3 de seu valor inicial.
-
A temperatura absoluta triplicou seu valor inicial.
Alternativa “e”.
T (K) = T (ºC) + 273
T (K) = 27 + 273
T (K) = 300 KP1V1 = P2V2
T1 T2
4 . 20 = 4 . 60
300 T280. T2 = 72000
T2 = 72000/80
T2 = 900 KSe a temperatura inicial era de 300 K e a final era de 900 K, isso significa que a temperatura absoluta (em kelvin) triplicou o seu valor inicial (3 . 300).
-