Exercícios sobre equações químicas
Em uma equação química, os símbolos indicam os elementos, os coeficientes indicam a quantidade de moléculas e os índices indicam a quantidade de átomos de cada elemento.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Em uma equação química é importante entender a quantidade de moléculas que reagem, o número dos elementos em cada molécula e a quantidade de átomos de cada elemento químico. Essas informações são indicadas em uma equação pelos coeficientes, pelos símbolos dos elementos e pelos índices. Indique essas três informações respectivamente na seguinte notação : 2 C2H4(OH)2.
-
2, 4, 10.
-
2, 3, 10.
-
4, 3, 20.
-
2, 4, 20.
-
2, 3, 20.
Alternativa “e”.
* O coeficiente na frente da molécula indica quantas moléculas estão reagindo: 2 C2H4(OH)2;
* Os símbolos indicam quantos elementos diferentes compõem a molécula: 3 - carbono, hidrogênio e oxigênio.
* Os índices indicam a quantidade de átomos: 2 C2H4(OH)2 → 2 carbonos, 6 hidrogênios (4 + 2) e 2 oxigênios (o índice 2 que está de fora do parênteses indica tanto a quantidade de oxigênios como de hidrogênios). Total: 2 + 6 + 2 = 10. Mas visto que são duas moléculas, temos que a quantidade total de átomos é igual a 20.
-
-
Questão 2
Faça a associação correta entre cada uma das reações apresentadas na coluna I e as equações que as representam na coluna II:
Coluna I:
-
Um dos modos de obtenção do óxido de cálcio é pela calcinação do calcário;
-
Quando o zinco reage com uma solução de sulfato de cobre, que é azul, observa-se a diminuição da intensidade da cor do sulfato de cobre;
-
A reação entre hidróxido de magnésio (suspensão esbranquiçada) e ácido clorídrico fornece uma solução resultante incolor;
-
Quando os gases oxigênio e hidrogênio reagem nas altas camadas da atmosfera, há formação de moléculas de água.
Coluna II:
( ) O2(g) + 2H2(g) → 2H2O(g)
( ) Mg(OH)2(g) + 2HCl(aq) → Mg(OH)2(s) + 2HCl(aq)
( ) CaCO3 → CaO + CO2
( ) Zn(s) + CuSO4(aq) → Cu(s) + ZnSO4(aq)
(4) O2(g) + 2H2(g) → 2H2O(g)
(3) Mg(OH)2(g) + 2HCl(aq) → Mg(OH)2(s) + 2HCl(aq)
(1) CaCO3 → CaO + CO2
(2) Zn(s) + CuSO4(aq) → Cu(s) + ZnSO4(aq)
-
-
Questão 3
(Mackenzie-SP) A água oxigenada, usada para limpar ferimentos, é uma solução aquosa de peróxido de hidrogênio que, na presença de luz, decompõe-se em água e gás oxigênio. A alternativa que possui essa reação corretamente equacionada e balanceada é:
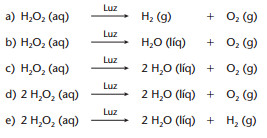
Alternativa “d”.
-
Questão 4
(Fuvest-SP) A sequência de reações:
x KHCO3 → M + CO2 + H2O
CO2 + Ba(OH)2 → N + H2O
ficará correta se x, M e N forem substituídos, respectivamente, por:
a) 1, K2CO3 e Ba2CO3.
b) 1, K2O2 e Ba2C.
c) 2, K2O e BaHCO3.
d) 2, K2CO3 e Ba2HCO3.
e) 2, K2CO3 e BaCO3.
Alternativa “e”.
2 KHCO3 → K2CO3 + CO2 + H2O
CO2 + Ba(OH)2 → BaCO3 + H2O