Exercícios sobre fórmulas químicas
As principais fórmulas químicas usadas para representar o número e o tipo de átomos que constituem uma molécula são: molecular, eletrônica e estrutural plana.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
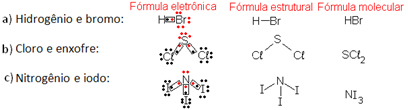
Os átomos dos elementos relacionados a seguir estabelecem entre si ligação(ões) covalente(s) para adquirir estabilidade. Forneça para cada caso a fórmula molecular, a estrutural e a eletrônica (de Lewis) das substâncias obtidas. Dados: 1H, 7N, 16S, 17Cℓ, 35Br, 53I.
-
Hidrogênio e bromo;
-
Cloro e enxofre;
-
Nitrogênio e iodo.
-
-
Questão 2
Os elementos nitrogênio, carbono, oxigênio e flúor estão situados, respectivamente, nas famílias IVA, VA, VIA, VIIA da tabela periódica. Com base nessas informações, represente as fórmulas estruturais das seguintes substâncias:
-
NF3
-
CF4
-
CO2
- NF3: F ─ N ─ F
│
F - CF4: F
│
F ─ C ─ F
│
F
- CO2: O ═ C ═ O
-
-
Questão 3
(Mack-SP) A fórmula do composto e o tipo de ligação que ocorre quando se combinam átomos dos elementos químicos Ba (Z = 56) e Cℓ (Z = 17) são, respectivamente:
-
BaCℓ e covalente normal.
-
Ba2Cℓ e dativa.
-
BaCℓ e iônica.
-
Ba2Cℓ2 e covalente normal.
-
BaCℓ2 e iônica.
Alternativa “e”.
O Ba é da família 2A ou 2 da tabela periódica , possuindo dois elétrons na camada de valência e precisando doá-los para ficar estável. Sua configuração eletrônica é: 2 – 8 – 18 – 18 – 8 -2. Já o Cℓ é da família 7A ou 17 da tabela periódica, possuindo sete elétrons na camada de valência e precisando receber 1 elétron para ficar estável. Sua configuração eletrônica é: 2 – 8 – 7.
Assim, a ligação é iônica, pois o Ba doa 2 elétrons, formando o cátion Ba2+ , e cada átomo de cloro recebe 1 elétron, formando o ânion Cℓ-. São necessários dois átomos de cloro.
Portanto, a fórmula molecular desse composto é: BaCℓ2.
-
-
Questão 4
(UFPA) Os átomos dos elementos se ligam uns aos outros através de ligações simples, dupla ou tripla, procurando atingir uma situação de maior estabilidade, e o fazem de acordo com a sua valência (capacidade de um átomo ligar-se a outros), conhecida através de sua configuração eletrônica.
Assim, verifica-se que os átomos das moléculas H2, N2, O2, Cℓ2 estão ligados de acordo com a valência de cada um na alternativa:
-
N ≡ N, O ═ O, Cℓ ─ Cℓ, H ─ H
-
H ─ H, N ≡ N, O ─ O, Cℓ ═ Cℓ
-
N ≡ N, O ─ O, H ═ H, Cℓ ═ Cℓ
-
H ─ H, O ≡ O, N ─ N, Cℓ ═ Cℓ
-
Cℓ ─ Cℓ, N ═ N, H ═ H, O ≡ O
Alternativa “a”.
Segundo a regra do octeto, temos:
Nitrogênio: trivalente. Faz três ligações covalentes comuns: N ≡ N.
Oxigênio: bivalente. Faz duas ligações covalentes comuns: O ═ O.
Cloro: monovalente. Faz uma ligação covalente comum: Cℓ ─ Cℓ.
Hidrogênio: monovalente. Faz uma ligação covalente comum: H ─ H. -