Exercícios sobre o grau de ionização dos ácidos
Pela condutividade elétrica das soluções, é possível verificar a extensão da ionização dos ácidos e classificá-los de acordo com o grau de ionização.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
A cada 6,115 L de sulfeto de hidrogênio gasoso, H2S, borbulhado na água, verifica-se que 4,647 . 10-3 L reagem, sofrendo ionização e formando o ácido sulfídrico, H3O1+(aq) . S-2(aq); todo o volume restante continua na forma molecular. Baseado no grau de ionização (α), indique se esse ácido sulfídrico é forte, moderado ou fraco.
Cálculo do grau de ionização (α):
α = _número de moléculas ionizadas_
número de moléculas dissolvidasα = 4,647 . 10-3
6,115α ≈ 0,00076 . 100% = 0,076%
O ácido sulfídrico é fraco, pois o seu grau de ionização é menor que 5%.
-
Questão 2
O ácido acético é um importante ácido orgânico que apresenta baixo grau de ionização. Em solução aquosa, constitui o tempero conhecido pelo nome de vinagre. De cada 1000 moléculas de ácido acético dissolvidas em água, apenas 13 sofrem ionização. Calcule o grau de ionização desse ácido e classifique-o quanto à sua força.
Cálculo do grau de ionização (α):
α = _número de moléculas ionizadas_
número de moléculas dissolvidasα = _13_
1000α = 0,013. 100% = 1,3%
O ácido acético é fraco, pois o seu grau de ionização é menor que 5%.
-
Questão 3
(Cesgranrio –RJ) Com base na tabela de graus de ionização apresentada a seguir,
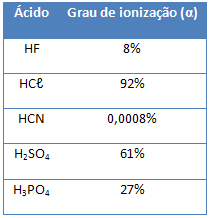
podemos concluir que o ácido mais forte é o:
-
HF.
-
HCℓ.
-
HCN.
-
H2SO4.
-
H3PO4.
Alternativa “b”.
O ácido mais forte é o HCℓ porque o seu grau de ionização é o maior.
-
-
Questão 4
(UECE-CE) Considere os seguintes ácidos, com seus respectivos graus de ionização (a 18°C) e usos:
- H3PO4 (α = 27%), usado na preparação de fertilizantes e como acidulante em bebidas refrigerantes;
- H2S (α = 7,6 . 10-2%), usado como redutor;
- HCℓO4 (α = 97%), usado na medicina, em análises químicas e como catalisador em explosivos;
- HCN (α = 8,0 . 10-3%), usado na fabricação de plásticos, corantes e fumigantes para orquídeas e poda de árvores.
Podemos afirmar que são corretas:
a) HCℓO4 e HCN são triácidos.
b) H3PO4 e H2S são hidrácidos.
c) H3PO4 é considerado um ácido semiforte.
d) H2S é um ácido ternário.
Alternativa “c”.
a) Incorreta, porque o HCℓO4 e o HCN são monoácidos, possuem somente um hidrogênio ionizável.
b) Incorreta, porque o H3PO4 é um oxiácido, visto que possui átomos de oxigênio.
c) Correta. H3PO4 é considerado um ácido semiforte porque o seu grau de ionização (27%) está entre 50% e 5%.
d) Incorreta, o H2S não é um ácido ternário, porque ele não possui três elementos diferentes, mas sim dois, o hidrogênio e o enxofre.