Exercícios sobre a Pilha de Daniell
A pilha de Daniell é feita por um eletrodo de zinco (ânodo) mergulhado em uma solução de sulfato de zinco e um eletrodo de cobre (cátodo), em uma solução de sulfato de cobre.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
(Unicamp-SP- modificada) Na pilha de Daniel (veja esquema adiante) ocorre a reação:
Zn(s) + Cu2+(aq) ↔ Zn2+(aq) + Cu(s)
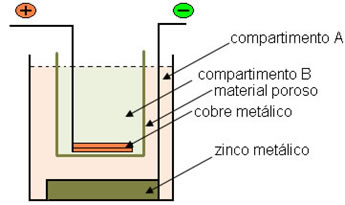
Qual das substâncias a seguir, dissolvida em água, você escolheria para colocar no compartimento B a fim de que a pilha possa produzir eletricidade? Justifique.
-
HCℓ
-
ZnCℓ
-
CuSO4
-
H2SO4
-
Na2SO4
-
PbS4
-
ZnSO4
Alternativa “c”.
O CuSO4(aq) é a única substância da lista que em solução aquosa fornece íons Cu2+(aq); esses recebem os elétrons fornecidos pelo zinco metálico, transformando-se em cobre metálico, Cu(s0, segundo a equação fornecida. Essa substância poderia ser substituída por outro sal solúvel que tivesse como cátion o Cu2+(aq).
-
-
Questão 2
(FURRN) Na pilha eletroquímica Zn0 / Zn2+ // Cu2+ / Cu0, ocorrem reações de oxirredução. Nesse sistema, pode-se afirmar que:
a) no polo negativo há oxidação de Cu0 a Cu2+.
b) no polo negativo há oxidação de Zn0 a Zn2+.
c) no polo positivo há oxidação de Cu0 a Cu2+.
d) no polo positivo há oxidação de Zn0 a Zn2+.
e) no polo positivo há redução de Zn2+ a Zn0.
Alternativa “b”.
A convenção mundial de representação das pilhas é feita com base na seguinte ordem:

Assim, a representação Zn0 / Zn2+ // Cu2+ / Cu0 indica que o Zn oxida-se a Zn2+ (no ânodo, polo negativo) e Cu2+ reduz-se a Cu (no cátodo, polo positivo).
-
Questão 3
Qual das afirmações abaixo indica corretamente o que aconteceria com a Pilha de Daniell se a barra de zinco fosse mergulhada em uma solução de sulfato de cobre (CuSO4(aq))?
-
A corrente elétrica iria correr no sentido oposto, pois agora o eletrodo de cobre que perderia elétrons para o eletrodo de zinco.
-
O zinco tornar-se-ia o polo positivo (cátodo).
-
Toda a reação de oxirredução pararia, pois o zinco não iria transferir mais elétrons e, desse modo, não haveria corrente elétrica.
-
Os elétrons seriam transferidos diretamente dos átomos de zinco metálico para os cátions Cu2+ da solução em que está mergulhado e deixariam de se movimentar através do fio, não havendo mais corrente elétrica.
-
Não haveria nenhuma alteração, pois o zinco continuaria perdendo elétrons para a placa de cobre.
Alternativa “d”.
-
-
Questão 4
Qual o cátodo e qual é o ânodo da pilha de Daniell, respectivamente?
-
Cátodo: Cu2+/Cu0 ; ânodo: Zn0/ Zn2+
-
Cátodo: Cu0/Cu2+ ; ânodo: Zn2+/Zn0
-
Cátodo: Zn2+/Zn0; ânodo: Cu0/Cu2+
-
Cátodo: Zn0/ Zn2+; ânodo: Cu2+/Cu0
-
Cátodo: Zn0/Cu2+; ânodo: Zn2+/Cu0
Alternativa “a”.
No cátodo, ou polo positivo, os íons Cu2+(aq) da solução de sulfato de cobre recebem elétrons e transformam-se em cobre metálico (Cu0(s)), enquanto no ânodo, ou polo negativo, o zinco metálico da placa (Zn0(s)) perde elétrons, transformando-se nos íons Zn2+(aq), que ficaram na solução de sulfato de zinco.
-