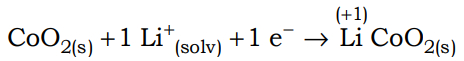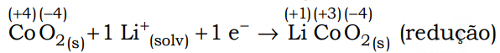Exercícios sobre pilhas e baterias de lítio
Estes exercícios sobre pilhas e baterias de lítio abordam os componentes e as principais caraterísticas do funcionamento desse tipo de dispositivo eletroquímico.
Publicado por: Diogo Lopes DiasQuestões
-
Questão 1
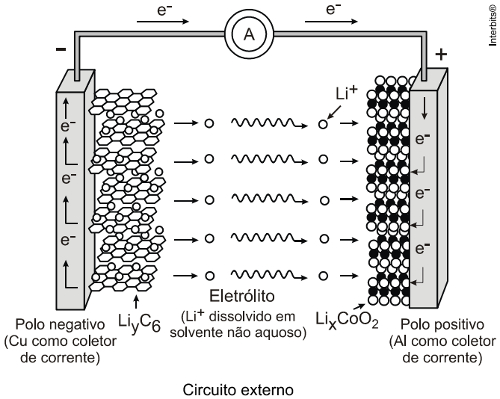
Em uma pilha ou bateria de lítio, o ânodo e o cátodo são formados por átomos dispostos em planos como se fossem lâminas com espaços onde os íons lítio inserem-se. O ânodo é formado por grafita com o metal cobre, e os íons intercalam-se nos planos de estruturas hexagonais de carbono, formando a substância LiyC6. Já o cátodo é formado pelos íons lítio intercalados em um óxido de estrutura lamelar, formado pelo metal:
a) Cobre.
b) Zinco.
c) Cobalto.
d) Níquel.
e) Cádmio.
Letra c)
-
Questão 2
Um tipo de pilha de lítio foi desenvolvido para ser usado em marca-passos cardíacos, já que é bastante leve, seguro (não libera gases, pois é fechado hermeticamente), tem uma boa durabilidade (cerca de 8 a 10 anos), fornece uma voltagem de 2,8 V e uma alta densidade de carga (0,8 Wh/cm3). Os eletrodos são formados por lítio e um complexo de iodo, que ficam separados por meio de uma camada cristalina de iodeto de lítio, a qual permite a passagem da corrente elétrica. O lítio metálico funciona como o ânodo dessa pilha, ou seja, é o polo negativo, que se oxida, perdendo elétrons. Já o cátodo, o polo positivo e que se reduz, é o complexo que possui o metal:
a) Cobre.
b) Zinco.
c) Cobalto.
d) Iodo.
e) Cádmio.
Letra d). A pilha que é utilizada no marca-passo apresenta em sua composição os elementos lítio e iodo.
-
Questão 3
(Uneb) O cátodo da célula eletroquímica é formado por óxido de lítio e de cobalto, LiCoO2(s), e o ânodo, por grafite, quando a bateria está descarregada. Durante a recarga, a corrente elétrica é invertida, e os íons de lítio são reduzidos no eletrodo de grafite. Na descarga, os íons de lítio, Li+, deixam a grafite, após reação e voltam a formar óxido de lítio e de cobalto. Com base nas informações do texto, das figuras e considerando-se o funcionamento de célula eletroquímica e a força eletromotriz de célula igual a 3,7 V, é correto afirmar:
a) O eletrólito é uma solução aquosa de sal de lítio.
b) O óxido de LiCoO2 é oxidado a CoO2, na recarga da pilha.
c) A oxidação e a redução ocorrem, respectivamente, no cátodo e no ânodo, durante a descarga da pilha.
d) A voltagem de bateria, formada a partir da ligação em paralelo de quatro células eletroquímicas de óxido de lítio-cobalto, é, aproximadamente, 15 V.
e) A ligação entre o cátodo e o ânodo através do separador, por meio de partículas metálicas, desvia o fluxo de corrente elétrica e causa resfriamento da célula eletroquímica.
Letra b)
a) Incorreta, porque, na presença de água, o lítio, por ser um metal alcalino, é extremamente reativo com ela.
b) Correta, porque o Lítio sofre redução, logo, o cobalto é oxidado.
c) Incorreta, porque a oxidação ocorre no ânodo, e a redução, no cátodo;
d) Incorreta, porque, quando associadas em paralelo, a ddp do grupo de pilhas é sempre igual à ddp na forma individual, ou seja, 3,7 V.
e) Incorreta, porque o material poroso do separador impede que os íons entrem em contato durante o tempo em que a pilha não está em funcionamento, aumentando assim o tempo de vida útil da pilha.
-
Questão 4
(Uel) Baterias de íon-lítio empregam o lítio na forma iônica, que está presente no eletrólito pela dissolução de sais de lítio em solventes não aquosos. Durante o processo de descarga da bateria, os íons lítio deslocam-se do interior da estrutura que compõe o ânodo (grafite) até a estrutura que compõe o cátodo 2 (CoO2), enquanto os elétrons se movem através do circuito externo:
Nesse processo, o cobalto sofre uma alteração representada pela equação a seguir.
Com base no enunciado, assinale a alternativa correta.
a) Durante a descarga, o número de oxidação do cobalto aumenta.
b) O cobalto recebe elétrons para haver a recarga da bateria.
c) No cátodo, o cobalto é reduzido durante a descarga.
d) O íon de lítio se desloca para o cátodo, durante a descarga, devido à atração magnética.
e) O solvente utilizado entre os polos deve ser um líquido orgânico apolar.
Letra c)
a) Incorreta. Durante a descarga, o número de oxidação do cobalto passa de +4 para +3, ou seja, diminui, logo, ele sofre uma redução.
b) Incorreta. Durante a recarga, o cobalto perde elétrons, já que, de acordo com a equação da descarga, ele recebe elétrons, ou seja, o inverso do processo.
c) Correta. No cátodo, está localizado sempre o material que sofre redução. Sabemos que na descarga o cobalto é reduzido, ou seja, seu número de oxidação diminui.
d) Incorreta. O íon de lítio desloca-se para o cátodo em razão da atração eletrostática, que resulta da diferença de cargas entre os íons.
e) Incorreta. Em solventes apolares, o lítio seria solúvel, por isso, o solvente utilizado deve ser apolar.