Exercícios sobre pilhas e sobre baterias
Resolva esta lista de exercícios sobre pilhas e sobre baterias, dispositivos químicos importantes para a geração de energia elétrica.
Publicado por: Stéfano Araújo NovaisQuestões
-
Questão 1
(PUC) Em um sistema eletroquímico de medição de diferença de potencial (estabelecida espontaneamente como numa pilha), um fio de cobre funciona como eletrodo sensível à concentração de íons Cu2+, e um fio de prata, recoberto com uma camada de AgCl (s), funciona como eletrodo de referência com potencial constante. As semirreações padrões de redução são as seguintes:
Cu2+ (aq) + 2 e− → Cu (s) E° = +0,34 V
AgCl (s) + e− → Ag (s) + Cl− (aq) E° = +0,20 V
Sobre esse sistema, é correto afirmar que
A) o eletrodo de cobre é o anodo.
B) na reação espontânea, a prata se oxida.
C) o potencial padrão da pilha é + 0,54 V.
D) os elétrons fluem do fio de cobre para o fio de prata recoberto.
Alternativa B.
Como o cobre tem um maior potencial de redução, neste caso, ele será reduzido, sendo o cátodo do processo, enquanto a prata deverá ser oxidada; logo, os elétrons saem do eletrodo de prata em direção ao cobre. E a d.d.p. é:
ΔE = +0,34 – (+0,20) = +0,14 V
-
Questão 2
(Enem) O quadro lista alguns dispositivos eletrônicos que estão presentes no dia a dia, bem como a faixa de força eletromotriz necessária ao seu funcionamento.
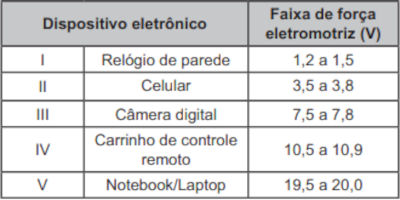
Considere que uma bateria é construída pela associação em série de três pilhas de lítio-iodo, nas condições-padrão, conforme as semiequações de redução apresentadas.
I2 + 2 e− → 2 I− E° = +0,54 V
Li+ + e− → Li E° = −3,05 V
Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?
A) I.
B) II.
C) III.
D) IV.
E) V.
Alternativa D.
O iodo, tendo maior potencial de redução, acaba por se reduzir nessa pilha, enquanto o lítio sofre oxidação. A d.d.p. será:
ΔE = +0,54 – (−3,05) = +3,59 V
Se três pilhas são associadas em série, então a voltagem é triplicada, ficando igual a +10,77 V. Nesse caso, a bateria é adequada para o funcionamento do carrinho de controle remoto.
-
Questão 3
(Enem digital) As pilhas recarregáveis, bastante utilizadas atualmente, são formadas por sistemas que atuam como uma célula galvânica, enquanto estão sendo descarregadas, e como célula eletrolítica, quando estão sendo recarregadas.
Uma pilha é formada pelos elementos níquel e cádmio e seu carregador deve fornecer uma diferença de potencial mínima para promover a recarga. Quanto maior a diferença de potencial gerada pelo carregador, maior será o seu custo. Considere os valores de potencial padrão de redução dessas espécies:
Ni2+ (aq) + 2 e− ⇌ Ni (s) E° = −0,230 V
Cd2+ (aq) + 2 e− ⇌ Cd (s) E° = −0,402 V
Teoricamente, para que um carregador seja ao mesmo tempo eficiente e tenha o menor preço, a diferença de potencial mínima, em volt, que ele deve superar é de
A) 0,086.
B) 0,172.
C) 0,316.
D) 0,632.
E) 1,264.
-
Questão 4
(Enem) Grupos de pesquisa em todo o mundo vêm buscando soluções inovadoras, visando à produção de dispositivos para a geração de energia elétrica. Dentre eles, pode-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.
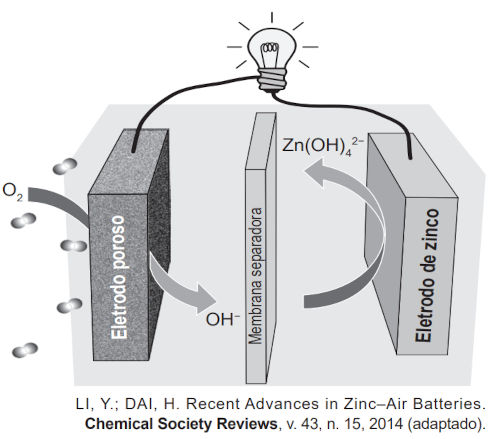
No funcionamento da bateria, a espécie química formada no ânodo é
A) H2 (g).
B) O2 (g).
C) H2O (l).
D) OH− (aq).
E) Zn(OH)42− (aq).
Alternativa E.
Ânodo é o eletrodo em que ocorre a oxidação. Quando o O2 vira OH− no eletrodo poroso, o seu número de oxidação passa de 0 para −2, configurando uma redução. Por isso, o eletrodo poroso é o cátodo; logo, o ânodo será o eletrodo de zinco. Percebe-se que o eletrodo de zinco possui zinco na forma metálica, cujo número de oxidação é igual a 0. O zinco é uma espécie que, na forma de compostos, sempre adquire carga igual a +2. Como a carga do zinco passa de 0 para +2, isso confirma que ele está se oxidando e a espécie que está sendo formada é Zn(OH)42−.
-
Questão 5
O fabricante de um dispositivo eletroeletrônico sem fio indica, no manual do produto, que o dispositivo deve ter uma voltagem mínima de 1,5 V. Um consumidor que adquiriu o produto decidiu comprar pilhas de níquel-cádmio para o funcionamento dele.
Determine o número mínimo de pilhas, em série, que devem ser utilizadas para o funcionamento do dispositivo eletroeletrônico sem fio.
Dados:
Ni2+ (aq) + 2e− → Ni (s) E° = −0,25 V
Cd2+ (aq) + 2e− → Cd (s) E° = −0,40 V
A) 2 pilhas.
B) 4 pilhas.
C) 6 pilhas.
D) 8 pilhas.
E) 10 pilhas.
Alternativa E.
A d.d.p. pode tranquilamente ser calculada pela fórmula:
ΔE = Emaior − Emenor = −0,25 – (−0,40) = + 0,15 V
Como a voltagem mínima deve ser de 1,5 V, são necessárias, portanto, 10 pilhas em série.
-
Questão 6
Considere as seguintes afirmações relacionadas às células eletroquímicas.
I. Uma pilha transforma energia química em energia elétrica.
II. Os elétrons em uma pilha saem do cátodo e migram para o ânodo.
III. A d.d.p. global da pilha é sempre um valor negativo.
IV. O processo químico em uma pilha é considerado espontâneo.
A opção que apresenta as afirmativas corretas é:
A) I, apenas.
B) I e IV.
C) I e II.
D) II e III.
E) II e IV.
Alternativa B.
A alternativa II está incorreta, pois no cátodo ocorre a redução, ou seja, as espécies captam os elétrons. Dessa forma, os elétrons saem do ânodo, no qual são produzidos por reações de oxidação, e migram para o cátodo.
Já a alternativa III está incorreta, pois as pilhas possuem d.d.p. global sempre positivo, o que indica, inclusive, que o processo é espontâneo.
-
Questão 7
Uma pilha é montada com base nos dois metais a seguir.
Cr3+ (aq) + 3 e− → Cr (s) E° = −0,74 V
Pb2+ (aq) + 2 e− → Pb (s) E° = −0,13 V
Considere, agora, as seguintes afirmativas:
I. A reação global da pilha é 3 Pb2+ (aq) + 2 Cr (s) → 3 Pb (s) + 2 Cr3+ (aq).
II. O cromo metálico é o cátodo da pilha.
III. A d.d.p. dessa pilha é igual a +0,87 V.
Estão corretas as afirmativas:
A) I e III.
B) II, apenas.
C) II e III.
D) III, apenas.
E) I, apenas.
Alternativa E.
A alternativa II está incorreta porque o cromo, como tem menor potencial de redução, sofrerá oxidação e, por conta disso, será o ânodo.
Já a alternativa III está incorreta porque a d.d.p. será calculada da seguinte forma:
ΔE = Emaior − Emenor = −0,13 – (−0,74) = + 0,61 V
-
Questão 8
Observe a seguinte pilha:
Zn2+ (aq) | Zn (s) || Al (s) | Al3+ (aq)
Indique a alternativa que apresenta a espécie química formada no cátodo, a espécie química formada no ânodo e a diferença de potencial desenvolvida pela pilha respectivamente.
Dados:
E° (Zn2+/Zn) = −0,76 V; E° (Al3+/Al) = −1,66 V
A) Zn2+, Al3+, −2,42 V.
B) Al, Zn, +0,90 V.
C) Al3+, Zn, −2,42 V
D) Zn, Al3+, +0,90 V.
E) Al, Zn2+, +0,90 V.
Alternativa D.
Nessa forma de representação da pilha, vê-se que o zinco se inicia na forma de Zn2+ e termina como Zn. Portanto, o zinco está sofrendo redução e é o cátodo da pilha. Já o alumínio inicia-se como Al e termina como Al3+, portanto, está se oxidando. Por isso, o alumínio é o ânodo.
A d.d.p. é dada por:
ΔE = Emaior − Emenor = −0,76 – (−1,66) = + 0,90 V
-
Questão 9
Quatro metais estavam disponíveis em um laboratório para um experimento de eletroquímica: ferro, zinco, cobre e alumínio.
Assinale a alternativa que apresenta o par de metais que produzirá a pilha de maior diferença de potencial.
Dados:
Fe2+ (aq) + 2e− → Fe (s) E° = −0,44 V
Zn2+ (aq) + 2e− → Zn (s) E° = −0,76 V
Cu2+ (aq) + 2e− → Cu (s) E° = +0,34 V
Al3+ (aq) + 3e− → Al (s) E° = −1,66 V
A) Fe e Zn.
B) Al e Zn.
C) Cu e Fe.
D) Cu e Al.
E) Fe e Al.
Alternativa D.
A pilha com maior d.d.p. será aquela formada pelo metal com maior potencial de redução junto ao metal com menor potencial de oxidação, conforme é possível ver pela análise da fórmula:
ΔE = Emaior − Emenor
Ou seja, quando maior a diferença, maior a d.d.p. Por isso, serão escolhidos o cobre (maior potencial de redução) e o alumínio (menor potencial de redução).
-
Questão 10
Sobre o funcionamento de uma pilha, são feitas as seguintes afirmativas.
I. As reações químicas de uma pilha são reversíveis.
II. Na superfície do cátodo ocorre a reação de redução.
III. O eletrodo para o qual migram os elétrons é chamado de ânodo.
IV. A massa final do ânodo é menor que a massa inicial.
Estão corretas as afirmativas:
A) I e II.
B) II e IV.
C) II, apenas.
D) III e IV.
E) I e III.
Alternativa B.
A afirmativa I está equivocada, pois as reações das pilhas são irreversíveis. O processo químico só é reversível em baterias.
A afirmativa III está incorreta, pois os elétrons são produzidos no ânodo, em que ocorrem reações de oxidação — perda de elétrons —, migrando para o cátodo.
-
Questão 11
Para uma suposta pilha formada por prata e zinco, espera-se que:
Dados:
Ag+ (aq) + e− → Ag (s) E° = +0,80 V
Zn2+ (aq) + 2e− → Zn (s) E° = −0,76 V
A) a prata sofra oxidação.
B) o eletrodo de zinco seja o cátodo.
C) a diferença de potencial da pilha seja igual a +0,04 V.
D) que o zinco sofra redução.
E) que o eletrodo de prata aumente a sua massa durante o processo reacional.
Alternativa E.
A prata se reduz nesse sistema, pois apresenta maior potencial de redução. Com base nisso, podemos afirmar que ocorrerá a deposição de prata metálica sobre o eletrodo. A deposição de novos átomos faz a sua massa aumentar.
-
Questão 12
É difícil imaginar a nossa vida sem a utilização das pilhas e das baterias. São usadas para providenciar energia para os dispositivos eletrônicos que estão em nossa volta.
A energia elétrica de uma pilha é advinda de uma reação química, conhecida como:
A) combustão.
B) neutralização.
C) oxirredução.
D) decomposição.
E) desidratação.
Alternativa C.
A energia de uma pilha só é possível por meio de reações químicas de oxirredução, pois são essas as reações que permitem o fluxo de elétrons; assim, gerando carga e corrente elétrica.