Exercícios sobre eletroquímica
Esta lista de exercícios faz um compilado de diversos temas de eletroquímica para você testar seus conhecimentos.
Publicado por: Stéfano Araújo NovaisQuestões
-
Questão 1
(Enem 2024) Placas solares comuns dependem de dias ensolarados para gerar energia. Mas podemos gerar eletricidade com a ajuda de gotas de chuva, revestindo placas solares com uma fina camada de grafeno. Os íons dissociados a partir da água da chuva (Am+ e Bn−) tornam a combinação grafeno e água da chuva um par perfeito para geração de energia. O processo requer apenas uma camada de grafeno para que grande quantidade de elétrons (e−) se movimente ao longo da superfície.
TANG, Q. et al. A Solar Cell that is Triggered by Sun and Rain. Angewandte Chemie International Edition, n. 55, 2016 (adaptado).
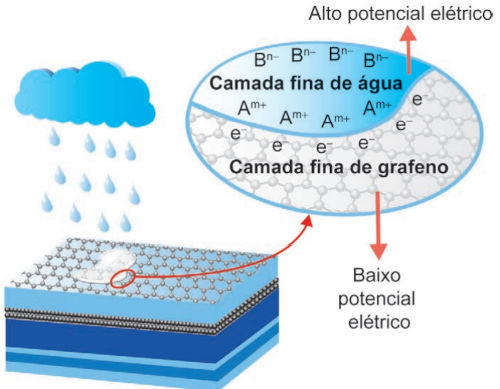
Ao produzir eletricidade em dias chuvosos, o grafeno:
A) oxida os cátions dissolvidos na água da chuva.
B) impede a difusão da água através das placas solares.
C) diminui a energia de ativação da reação no pseudocapacitor.
D) forma um compósito não metálico com os íons na água da chuva.
E) gera uma diferença de potencial pela interação dos elétrons com os cátions.
Alternativa: Letra E.
A produção de eletricidade é consequência de uma diferença de potencial. Uma diferença de potencial elétrico se forma devido a um gradiente de elétrons, o qual acontece entre as camadas fina de grafeno e de água, conforme mostra a figura.
-
Questão 2
(Enem PPL/2024) Pesquisadores da Universidade de Wisconsin-Madison, nos Estados Unidos, desenvolveram um dessalinizador-pilha.
O invento se mostrou muito promissor para dessalinizar água do mar, empregando eletrodos com bismuto e titânio em suas composições. Para realizar a dessalinização, o dispositivo funciona por eletrólise, conforme a figura. No descarregamento do dispositivo ocorre o processo inverso, que permite reaproveitar a energia, como em uma pilha.
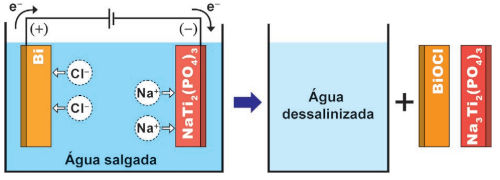
NAM, D.-H.; CHOI, K.-S. Bismuth as a New Chloride-Storage Electrode Enabling the Construction of a Practical High Capacity Desalination Battery. Journal of the American Chemical Society, n. 139, 2017 (adaptado).
Durante a dessalinização da água por eletrólise ocorre a formação de
A) BiOCl no ânodo.
B) H2 (g) no cátodo.
C) Bi no polo positivo.
D) O2 (g) no polo negativo.
E) Na3Ti2(PO4)3 no ânodo.
Alternativa: Letra A.
No ânodo, ocorre a oxidação. Percebe-se, pela imagem, a transformação do Bi, cujo NOX é igual a 0, em BiOCl, no qual o NOX do bismuto passa a ser +1. Também é possível chegar a essa conclusão uma vez que os elétrons saem do eletrodo de Bi em direção ao outro eletrodo. Vale lembrar que, na oxidação, há perda de elétrons.
-
Questão 3
(Enem 2024) Células a combustível microbianas (CCM) são capazes de gerar eletricidade a partir de águas residuárias urbanas e agroindustriais. As CCM são compostas de duas câmaras.
Numa delas, onde ocorre o tratamento da matéria orgânica, as bactérias eletrogênicas crescem formando um biofilme e se alimentam dos poluentes presentes no efluente. Ao se alimentarem, essas bactérias geram uma corrente elétrica que percorre o material sobre o qual elas formaram o biofilme.
Um fio condutor externo possibilita a migração dessa corrente para uma segunda câmara, promovendo uma reação química.
A figura esquematiza uma CCM e as reações envolvidas.
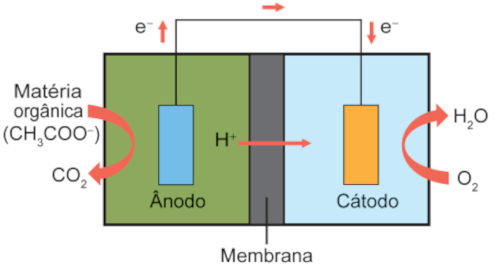
CH3COO− (aq) + 2 H2O (l) → 2 CO2 (g) + 7 H+ (aq) + 8 e−
4 H+ (aq) + O2 (g) + 4 e− → 2 H2O (l)
QUINTO, A. C. Biobaterias geram eletricidade a partir de esgoto sanitário e efluentes agroindustriais. Disponível em: https://jornal.usp.br. Acesso em: 1 dez. 2021 (adaptado).
Qual das equações representa a reação global que ocorre durante o funcionamento dessa CCM?
A) CH3COO− (aq) + O2 (g) → 2 CO2 (g) + 3 H+ (aq)
B) CO2 (g) + O2 (g) + H+ (aq) → H2O (l) + CH3COO− (aq)
C) CH3COO− (aq) + H+ (aq) + 2 O2 (g) → 2 CO2 (g) + 2 H2O (l)
D) CH3COO− (aq) + 6 H2O (l) → 2 CO2 (g) + 2 O2 (g) + 15 H+ (aq)
E) 2 CO2 (g) + 11 H+ (aq) + O2 (g) → CH3COO− (aq) + 4 H2O (l)
Alternativa: Letra C.
A equação da reação global consiste na soma da reação anódica com a soma da reação catódica da CCM, de modo que não existam elétrons na versão final.
Reação anódica: CH3COO− (aq) + 2 H2O (l) → 2 CO2 (g) + 7 H+ (aq) + 8 e−
Reação catódica: 4 H+ (aq) + O2 (g) + 4 e− → 2 H2O (l)
Multiplica-se a reação catódica por 2, de modo a se igualar os elétrons.
Reação anódica: CH3COO− (aq) + 2 H2O (l) → 2 CO2 (g) + 7 H+ (aq) + 8 e−
Reação catódica: 8 H+ (aq) + 2 O2 (g) + 8 e− → 4 H2O (l)
Agora, faz-se o somatório, anulando-se os elétrons e diminuindo as quantidades dos participantes que estão em lados opostos. O resultado é:
CH3COO− (aq) + H+ (aq) + 2 O2 (g) → 2 CO2 (g) + 2 H2O (l)
-
Questão 4
(Enem 2022) A nanotecnologia é responsável pelo aprimoramento de diversos materiais, incluindo os que são impactados com a presença de poluentes e da umidade na atmosfera, causadores de corrosão. O processo de corrosão é espontâneo e provoca a deterioração de metais como o ferro, que, em presença de oxigênio e água, sofre oxidação, conforme ilustra a equação química:
4 Fe (s) + 2 H2O (l) + 3 O2 (g) → 2 Fe2O3·H2O (s)
Uma forma de garantir a durabilidade da estrutura metálica e a sua resistência à umidade consiste na deposição de filmes finos nanocerâmicos à base de zircônia (ZrO2) e alumina (Al2O3) sobre a superfície do objeto que se deseja proteger.
CLEMENTE, G.A. B. F. et al. O uso de materiais híbridos ou nanocompósitos comorevestimentos anticorrosivos do aço. Química Nova, n. 9, 2021 (adaptado).
Essa nanotecnologia aplicada na proteção contra a corrosão se baseia no(a):
A) proteção catódica, que utiliza um metal fortemente redutor.
B) uso de metais de sacrifício, que se oxidam no lugar do ferro.
C) passivação do ferro, que fica revestido pelo seu próprio óxido.
D) efeito de barreira, que impede o contato com o agente oxidante.
E) galvanização, que usa outros metais de menor potencial de redução.
Alternativa: Letra E.
A deposição de filmes em torno de uma superfície é um processo conhecido como galvanização. A ideia é recobrir um metal para protegê-lo dos efeitos da oxidação/corrosão.
-
Questão 5
Para a formação de uma pilha, dois eletrodos, geralmente hastes metálicas, são mergulhados em soluções contendo seus respectivos íons. A diferença de potencial gerada por tal dispositivo pode ser mensurada a partir das semirreações de redução dos participantes do processo, juntamente com seus potenciais-padrão de redução, como no caso a seguir.
Cd2+ (aq) + 2 e− → Cd (s) E° = –0,40 V
Ag+ (aq) + e− → Ag (s) E° = +0,80 V
Com base no que foi exposto, assinale a alternativa que indica, corretamente, a diferença de potencial de uma pilha formada entre prata (Ag) e cádmio (Cd).
A) +0,40 V
B) +1,20 V
C) −1,20 V
D) −0,40 V
E) +2,00 V
Alternativa: Letra B.
Uma forma fácil e rápida de se determinar a diferença de potencial (ddp) de uma pilha é por meio da seguinte equação:
Epilha = E°red. (maior) – E°red. (menor)
Assim sendo:
Epilha = +0,80 V – (–0,40 V)
Epilha = +1,20 V
-
Questão 6
Um famoso processo eletroquímico é a cromagem, que consiste no revestimento de peças metálicas por um filme de cromo. Para tal, a peça metálica é submersa em uma solução de íons de cromo, que serão depositados sobre ela mediante redução. A semirreação de redução do cromo é a que se segue:
Cr3+ (aq) + 3 e− → Cr (s)
Considerando que foram depositados 130 gramas de cromo sobre uma peça metálica, utilizando uma solução de íons Cr3+ e uma corrente de 9,65 A, indique a alternativa que apresenta o tempo, em minutos, necessário para a completa deposição dessa quantidade de cromo.
Dados: Constante de Faraday = 96500 C/mol; massa molar do cromo (Cr) = 52 g/mol.
A) 1650 minutos.
B) 1500 minutos.
C) 1250 minutos.
D) 2000 minutos.
E) 1000 minutos.
Alternativa: Letra E.
Como são envolvidos 3 mols de elétrons na redução do íon Cr3+ em Cr, podemos dizer que:
1 mol Cr -------- 3 mols e− ---------- 3 x 96500 C
Assim:
1 mol Cr ------------ 289500 C
130 g Cr ------------ x
Portanto:
52 g Cr ------------- 289500 C
130 g Cr ------------ x
52 · x = 130 · 289500
x = 2 · 289500
x = 579000 C
A corrente (i) é a quantidade de carga (q) que passa por uma determinada seção em um determinado intervalo de tempo (t), logo:
i = q/t
q = i·t
579000 = 9,65 · t
t = 579000/9,65
t = 60000 s
t = 1000 min
-
Questão 7
Uma câmera digital necessita de cerca de 7,0 V de diferença de potencial para seu funcionamento adequado.
Suponha que, para ligar esse dispositivo, serão utilizadas pilhas de lítio-iodo em série.
Indique o número de pilhas em série que deverão ser utilizadas.
Dados:
- Eºred. I2/2I- = +0,54 V
- Eºred. Li+/Li = -3,05 V
A) 2.
B) 3.
C) 4.
D) 5.
E) 6.
Alternativa: Letra A.
O potencial global da pilha é calculado da seguinte forma: +0,54 - (-3,05) = +3,59 V.
Na associação em série, as voltagens se somam. Sendo assim, são necessárias duas pilhas em série para fazer a ligação da câmera digital.
-
Questão 8
Uma determinada pilha possui a seguinte reação global:
3 Cu2+ (aq) + 2 Fe (s) → 3 Cu (s) + 2 Fe3+ (aq)
Acerca dessa pilha, é possível afirmar que:
A) O processo é espontâneo e, portanto, a diferença de potencial dessa pilha é menor que zero.
B) O eletrodo de Cu (s) é o cátodo da pilha.
C) Os elétrons irão migrar do eletrodo de cobre para o eletrodo de ferro.
D) O processo utiliza energia elétrica para desencadear o processo químico.
E) O ferro está sofrendo redução para o pleno funcionamento da pilha.
Alternativa: Letra B.
Toda pilha é um processo espontâneo que gera energia elétrica, apresentando, portanto, uma diferença de potencial sempre positiva. No caso, percebe-se que o cobre sofre redução (Cu2+ para Cu), pois recebe elétrons produzidos pelo eletrodo de ferro, que está sofrendo oxidação (Fe para Fe3+). Como a redução ocorre no eletrodo de cobre, ele é definido como sendo o cátodo.
-
Questão 9
Uma das formas de produção industrial do gás cloro, Cl2, é por meio da eletrólise aquosa do cloreto de sódio, NaCl. Nesse processo, o gás cloro é produzido no ânodo, enquanto outro gás, também diatômico, é produzido no cátodo.
Assinale a alternativa que contempla a substância formada no cátodo da eletrólise aquosa do NaCl.
A) H2.
B) O2.
C) NaOH.
D) H2O.
E) HClO.
Alternativa: Letra A.
No cátodo da eletrólise da solução aquosa do NaCl, pode ocorrer a redução de um dos seguintes cátions: H+ ou Na+. Contudo, o íon H+ é mais propenso a reduzir que o cátion de metal alcalino, Na+. Portanto, percebe-se a seguinte reação no cátodo:
2 H+ (aq) + 2 e− → H2 (g)
-
Questão 10
Uma célula galvânica é formada pelos eletrodos de níquel (Ni) e zinco (Zn) imersos em soluções de seus respectivos cátions (Ni2+ e Zn2+), na concentração de 1 mol/L cada um. Os potenciais padrão de redução são o que se seguem:
Ni2+ (aq) + 2 e− → Ni (s) E° = −0,25 V
Zn2+ (aq) + 2 e− → Zn (s) E° = −0,76 V
Assinale a alternativa que apresenta a informação correta acerca do funcionamento desse dispositivo eletroquímico.
A) Durante o funcionamento da célula, os elétrons migram do eletrodo de maior potencial de redução para o eletrodo de menor potencial de redução.
B) Ao fim do funcionamento da célula, percebe-se que o eletrodo de zinco sofreu redução na sua massa.
C) Durante a operação, ocorre aumento da concentração de íons Ni2+ na solução.
D) A diferença de potencial da célula é igual a +1,01 V.
E) A equação global é Zn2+ + Ni → Zn + Ni2+.
Alternativa: Letra B.
Durante o funcionamento dessa célula galvânica, que é uma pilha, ocorre a redução do níquel (que possui maior potencial de redução) e oxidação do zinco (que possui menor potencial de redução). Dessa forma, os elétrons migram do eletrodo de zinco (que tem menor potencial) para o eletrodo de níquel. Ao se acumularem na superfície do eletrodo de níquel, os elétrons atraem os íons Ni2+ presentes na solução, fazendo com que sua concentração caia.
Ni2+ (aq) + 2 e− → Ni (s)
Na oxidação do zinco presente no eletrodo, parte do zinco metálico passa para a solução, mediante dissolução e, portanto, sua massa decai.
Zn (s) → Zn2+ (aq) + 2 e−
A ddp da pilha será igual a +0,51 V, pois é o resultado da diferença entre o maior potencial de redução pelo menor potencial de redução.
-
Questão 11
Um dos grandes problemas das cidades é a corrosão, que consiste na deterioração constante de estruturas metálicas por ação do gás oxigênio e da umidade presentes no ar. O ferro, principal componente do aço, é uma das grandes vítimas do processo de corrosão e que, no caso desse elemento, é comumente denominado “enferrujamento”.
No processo de enferrujamento, inicialmente, o ar e a umidade promovem a transformação do ferro em íons Fe2+:
2 Fe (s) + O2 (g) + 2 H2O (l) → 2 Fe2+ (aq) + 4 OH− (aq)
Depois, os íons Fe2+ são transformados em uma mistura de óxidos e hidróxidos de ferro, também por ação do oxigênio presente, que é a chamada ferrugem.
2 Fe2+ (aq) + O2 (g) + 4 OH− (aq) → 2 FeOOH (s) + 2 H2O (l)
Acerca do processo corrosivo descrito, assinale a alternativa correta:
A) Os átomos de ferro são reduzidos durante o processo de enferrujamento.
B) O enferrujamento poderia ser diminuído caso fosse colocado um metal com maior potencial de redução próximo ao ferro.
C) Ao fim do processo de enferrujamento, a estrutura mantém as suas propriedades mecânicas, apesar das alterações visuais.
D) Percebe-se que o gás oxigênio atua como agente oxidante.
E) A corrosão do ferro é menos acelerada em regiões litorâneas.
Alternativa: Letra D.
-
Questão 12
As baterias automotivas, ou de chumbo-ácido, são formadas por seis células galvânicas de 2 V, onde os eletrodos estão submersos em uma solução de ácido sulfúrico, H2SO4. Durante a sua descarga, ocorrem as seguintes semirreações:
PbO2 (s) + H2SO4 (aq) + 2 H+ (aq) + 2 e− → PbSO4 (s) + 2 H2O (l)
Pb (s) + H2SO4 (aq) → PbSO4 (s) + 2 H+ (aq) + 2 e−
Dentre os componentes dessa célula galvânica, pode-se dizer que a função da solução aquosa de ácido sulfúrico é:
A) atuar como ânodo de cada célula galvânica.
B) atuar como catalisador, de modo a tornar a reação de descarga mais rápida.
C) atuar como um protetor à corrosão dos eletrodos.
D) atuar como solução eletrolítica, permitindo o fluxo da corrente elétrica entre os eletrodos.
E) atuar como cátodo de cada célula galvânica.
Alternativa: Letra D.
A solução aquosa de H2SO4 apresenta os íons H+ e SO42− dispersos, configurando uma solução eletrolítica, a qual permite a difusão dos elétrons e, assim, o fluxo da corrente elétrica entre os eletrodos.