Exercícios sobre Polaridade das Ligações
A polaridade das ligações é classificada assim: as ligações iônicas são polares, já as covalentes podem ser apolares ou polares, depende da diferença de eletronegatividade.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Determine se as ligações a seguir são polares ou apolares e especifique também se são iônicas ou covalentes:
a) H2
b) HCl
c) Cl2
d) CO2
e) NH3
a) Ligação covalente apolar
b) Ligação covalente polar
c) Ligação covalente apolar
d) Ligações covalentes polares
e) Ligações covalentes polares
-
Questão 2
Escreva as fórmulas estruturais de cada uma das moléculas abaixo. Depois classifique-as como polares ou apolares e indique o sentido do dipolo elétrico das classificadas como polares
a) N2
b) HCN
c) H2O
d) O2
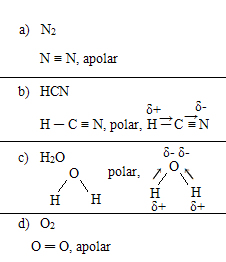
-
Questão 3
(FUC – MT) A ligação covalente de maior polaridade ocorre entre H e átomos de:
a) F
b) Cl
c) Br
d) I
e) At
Alternativa “a”. Na escala de eletronegatividade de Pauling, o flúor é o mais eletronegativo e o hidrogênio é o mais eletropositivo.
-
Questão 4
(FCMSC-SP) Na escala de eletronegatividade, tem-se:
Li H Br N O
1,0 2,1 2,8 3,0 3,5
Esses dados permitem afirmar que, entre as moléculas a seguir, a mais polar é:
a) O2 (g)
b) LiBr (g)
c) NO (g)
d) HBr (g)
e) Li2 (g)
Alternativa “b”.