Exercícios sobre saturação das soluções
De acordo com a saturação das soluções, elas podem ser classificadas em: insaturadas, saturadas, saturadas com corpo de chão e supersaturadas.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Considere este gráfico:
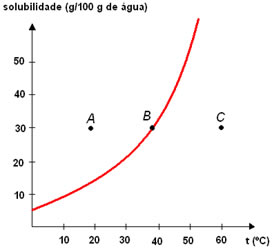
As soluções indicadas pelos pontos A, B e C podem ser classificadas quanto à saturação, respectivamente, como:- Insaturada, saturada com corpo de chão, supersaturada.
- Saturada, insaturada, saturada com corpo de chão.
- Saturada com corpo de chão, saturada, insaturada.
- Supersaturada, insaturada, saturada.
- Saturada com corpo de chão, supersaturada, insaturada.
Alternativa “c”.
- Ponto A:
Analisando o gráfico, verifica-se que a quantidade de soluto presente em 100 g de água de solvente (água), à temperatura de 20ºC, é de aproximadamente 30g para o ponto A. Como a curva indica a quantidade máxima de soluto numa dada temperatura, podemos verificar que, a 20ºC, essa quantidade é de 15 g. Portanto, no ponto A, temos mais soluto que o máximo que pode ser dissolvido e, consequentemente, a solução é saturada com corpo de chão.
- Ponto B:
O ponto B está situado sobre a curva e, nesse caso, a quantidade de soluto também é de 30 g, mas a temperatura é de 40ºC. Para tal temperatura, essa é a quantidade máxima que pode ser dissolvida em 100 g de água. Portanto, a solução é saturada.
- Ponto C:
Nesse ponto, uma massa de 30g de soluto está dissolvida em água à temperatura de 60ºC. Nessa temperatura, a quantidade máxima de soluto que pode ser dissolvida é maior que 30g. Portanto, a solução é insaturada.
Basicamente, temos que:
-
Pontos acima da curva: soluções saturadas com corpo de chão;
-
Pontos na curva: soluções saturadas;
-
Pontos abaixo da curva: soluções insaturadas.
-
Questão 2
Observe a tabela de solubilidade abaixo para várias substâncias:
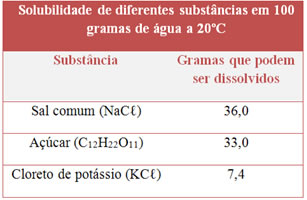
Classifique o tipo de solução (saturada, insaturada ou supersaturada) que obteremos se adicionarmos essas massas de soluto a 100 g de água, à temperatura de 20ºC:
- 50 g de NaCℓ;
- 33,0 g de açúcar;
- 5,0 g de KCℓ.
-
Saturada, supersaturada, insaturada.
-
Saturada, insaturada, saturada.
-
Insaturada, saturada, supersaturada.
-
Supersaturada, insaturada, saturada.
-
Saturada, saturada, insaturada.
Alternativa “e”.
-
Questão 3
(UFMG) Adicionando-se soluto a um solvente chega-se a um ponto em que o solvente não mais consegue dissolver o soluto. Neste ponto a solução torna-se:
-
Diluída.
-
Concentrada.
-
Fraca.
-
Supersaturada.
-
Saturada
Alternativa “e”.
-
-
Questão 4
(UFGO) O gráfico a seguir representa a solubilidade de vários sais em função da temperatura, expressa em gramas do soluto por 100 gramas de água.
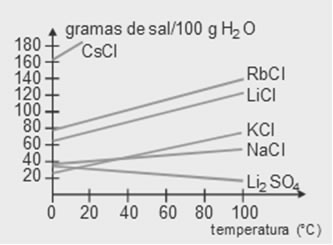
Sobre esse gráfico, é incorreto afirmar que:
a) a solubilidade dos sais aumenta com a elevação da temperatura na ordem: NaCl, KCl, RbCl, CsCl.
b) com exceção do Li2SO4, a solubilidade de todos os sais aumenta com a elevação da temperatura.
c) a solubilização do KCl aumenta com o aumento da temperatura.
d) a 0 °C , o NaCl é menos solúvel que o KCl.
Alternativa ‘d’.