Exercícios sobre Tonoscopia
A tonoscopia é uma propriedade coligativa que estuda a diminuição da pressão máxima de vapor de um solvente, provocada pela adição de um soluto não volátil.
Publicado por: Jennifer Rocha Vargas FogaçaQuestões
-
Questão 1
Uma solução anticongelante contém cerca de 650 g de etilenoglicol dissolvidos em 1,5 kg de água. Determine o valor porcentual da queda de pressão de vapor nessa solução em função da Lei de Raoult, sendo que as massas molares da água e do etilenoglicol são, respectivamente, 18 g/mol e 62 g/mol.
a) 23%
b) 11%
c) 15%
d) 31%
e) 0,1%
Alternativa “b”.
Dados:
m1= 650 g de etilenoglicol
M1= 62 g/mol
m2= 1500 g de água
M2= 18 g/molUtilizando a Lei de Raoult, temos:
∆P = x1 . P2
∆P= x1
P2Onde:
∆P = abaixamento absoluto da pressão máxima de vapor (depende da temperatura);
P2 é a pressão de vapor do solvente, no caso, da água;
x1 = fração molar do solutoA relação ∆P/P2 é o abaixamento relativo da pressão máxima de vapor que não depende da temperatura e é o que queremos encontrar.
Observe que para descobrir esse abaixamento relativo da pressão máxima de vapor (∆P/P2) é preciso saber o valor da fração molar do soluto (x1) que é dada por:
x1 = ____n1___
n1 + n2Por sua vez, n = m/M. Assim, temos:
n1= m1_ → n1= 650 g_____→ n1= 10,5 mol
M1 62 g/mol
n2= m2_ → n2= 1500 g_____→ n2= 83,3 mol
M2 18 g/molx1 = _____10,5 mol_____________
(10,5+ 83,3) molx1 = _10,5 mol__ 93,8
x1 = 0,011 ou 11%
Aplicando na fórmula da lei de Raoult:
∆P= x1
P2∆P= 11%
P2Portanto, a queda da pressão de vapor da água é de 11%.
-
Questão 2
A pressão de vapor da água pura é de 6,4 kPa a 25 °C. Qual será a pressão de vapor de uma solução à mesma temperatura que possui 0,8 mol de glicose em 4,0 mol de água?
Dados:
Psolução = ?
Psolvente puro = 6,4 kPa
nsolvente = 4,0 mol
nsoluto = 0,8 mol
xsolvente = ?Utilizando a Lei de Raoult, temos:
Psolução = xsolvente . Psolvente puro
Psolução = xsolvente . 6,4 kPaÉ preciso, portanto, descobrir a fração em mol da água:
X solvente = _____n solvente_____________
n solvente + nsolutoX solvente = _____4,0 mol_____________
(4,0+ 0,80) mol
X solvente = 0,833Retornando à expressão da Lei de Raoult, e substituindo o valor da fração molar da água, encontramos a pressão de vapor da solução formada:
Psolução = 0,833. 6,4 kPa
Psolução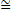 5,333 kPa
5,333 kPa -
Questão 3
Uma solução aquosa diluída foi preparada dissolvendo-se 123 g de glicose (C6H12O6) em 960 g de água. Sabendo que a pressão máxima de vapor da água no local é igual a 650 mmHg a uma dada temperatura, calcule o abaixamento absoluto da pressão máxima de vapor que ocorreu com a adição da glicose. (Dados = massas molares: H2O = 18 g/mol; C6H12O6 = 180 g/mol).
Dados:
m1= 123 g de C6H12O6
M1= 180 g/mol
m2= 960 g de C6H12O6
M2= 18 g/mol
P2 = 650 mmHgUtilizando a Lei de Raoult, temos:
∆P = x1 . P2
∆P= x1 . 650 mmHgObserve que para descobrir o abaixamento absoluto da pressão máxima de vapor (∆P) é preciso saber também a fração molar do soluto (x1), que é dada por:
x1 = _____n 1_____________
n 1 + n2Por sua vez, n = m/M. Assim, temos:
n1= m 1_ → n1= 123 g_____→ n1= 0,6833 mol
M1 180 g/mol
n2= m2_ → n2= 960 g_____→ n2= 53,333 mol
M2 18 g/molx1 = _____0,6833_____________
0,6833+ 53,333x1 = _0,6833__ 54,017
x1 = 0,01265
Agora, podemos aplicar na fórmula da lei de Raoult:
∆P= 0,01265. 650
∆P= 82,225 mmHg
-
Questão 4
(Vunesp-SP) A uma dada temperatura, possui a menor pressão de vapor a solução aquosa:
a) 0,1 mol/L de C12H22O11.
b) 0,2 mol/L de C12H22O11.
c) 0,1 mol/L de HCℓ.
d) 0,2 mol/L de HCℓ.
e) 0,1 mol/L de NaOH.
Alternativa “d”.
A pressão de vapor da solução é tanto menor quanto maior for o número de partículas dissolvidas na solução. Considerando que o α% = 100% para todos os casos, temos:
a) 1 C12H22O11(s)→ 1 C12H22O11(aq)
0,1 mol 0,1 mol
Total = 0,1 mol de partículas em solução.b) 1 C12H22O11(s)→ 1 C12H22O11(aq)
0,2 mol 0,2 mol
Total = 0,2 mol de partículas em solução.c) 1 HCℓ(g) + 1 H2O(ℓ) → 1 H3O+(aq) + Cℓ-(aq)
0,1 mol 0,1 mol 0,1 mol 0,1 mol
Total = 0,2 mol de partículas em solução.d) 1 HCℓ(g) + 1 H2O(ℓ) → 1 H3O+(aq) + Cℓ-(aq)
0,2 mol 0,2 mol 0,2 mol 0,2 mol
Total = 0,4 mol de partículas em solução.c) 1 NaOH(s) → 1 Na+(aq) + 1 OH-(aq)
0,1 mol 0,1 mol 0,1 mol
Total = 0,2 mol de partículas em solução. -
Questão 5
(UFSC) Observe a figura abaixo e selecione as opções corretas:
01. A dissolução do soluto, no líquido puro, diminui a pressão de vapor do líquido.
02. A pressão de vapor do líquido em solução é maior que a do líquido puro.
04. A pressão de vapor do líquido não varia após a dissolução do soluto.
08. Na mesma temperatura, a pressão de vapor do líquido puro é maior que a do líquido em solução.
16. O abaixamento da pressão de vapor do líquido na solução é diretamente proporcional à sua fração em quantidade de matéria.
O total das opções corretas é igual a 25.
01. Correto.
02. Falso. A pressão de vapor do líquido em solução é sempre menor que a do líquido puro.
04. Falso. A pressão de vapor do líquido varia sim com a dissolução do soluto.
08. Correto.
16. Correto.
Portanto, 1 + 8 + 16 = 25.
-
Questão 6
(Vunesp-SP) No gráfico a seguir as curvas I, II, III e IV correspondem à variação de pressão de vapor em função da temperatura de dois líquidos puros e das respectivas soluções de mesma concentração de um mesmo sal nesses dois líquidos. O ponto de ebulição de um dos líquidos é 90 °C.
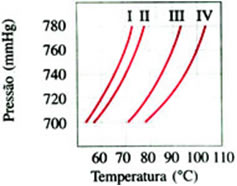
Utilizando os números das curvas respectivas:
a) Indicar quais curvas correspondem aos líquidos puros. Indicar entre os dois qual é o líquido mais volátil e justificar.
b) Indicar quais curvas correspondem às soluções. Justificar.
a) Admitindo-se que a pressão é ao nível do mar (760 mmHg), o líquido III é puro, porque possui ponto de ebulição 90ºC. O líquido I também é puro, sendo mais volátil que III, pois apresenta maior pressão de vapor numa mesma temperatura.
b) II é a solução na qual o solvente é I, e IV é a solução na qual o solvente é III (as soluções têm pressão de vapor menor que seus respectivos solventes puros).